
【題目】現有部分短周期元素的性質或原子結構如表:
元素編號 | 元素性質或原子結構 |
A | 有三個電子層,K、M層電子數之和等于L層電子數 |
B | 短周期中金屬性最強 |
C | 常溫下單質為雙原子分子,氫化物的水溶液呈堿性 |
D | 元素最高正價是 |
![]() 用化學用語回答下列問題:
用化學用語回答下列問題:
![]() 元素在周期表中的位置 ______ ;
元素在周期表中的位置 ______ ;![]() 單質分子的電子式 ______ ;
單質分子的電子式 ______ ;
![]() 的原子結構示意圖 ______ ;
的原子結構示意圖 ______ ;![]() 電子式表示A和B元素組成的化合物的形成過程: ______ .
電子式表示A和B元素組成的化合物的形成過程: ______ .
![]() 元素D與元素A相比,非金屬性較強的是 ______
元素D與元素A相比,非金屬性較強的是 ______ ![]() 用元素符號表示
用元素符號表示![]() ,下列表述中能證明這一事實的是 ______
,下列表述中能證明這一事實的是 ______ ![]() 填選項序號
填選項序號![]() .
.
![]() 常溫下D的單質和A的單質狀態不同
常溫下D的單質和A的單質狀態不同
![]() 的氫化物比A的氫化物穩定
的氫化物比A的氫化物穩定
![]() 一定條件下D和A的單質都能與鈉反應
一定條件下D和A的單質都能與鈉反應
![]() 最高價含氧酸的酸性弱于D最高價含氧酸
最高價含氧酸的酸性弱于D最高價含氧酸
![]() 單質能與A的氫化物反應生成A單質
單質能與A的氫化物反應生成A單質
![]() 是由A、B、C、D四種元素中的某種元素組成的單質,能經圖所示的過程轉化為
是由A、B、C、D四種元素中的某種元素組成的單質,能經圖所示的過程轉化為![]() 其他條件略去
其他條件略去![]() .
.
![]()
![]() 若Y是有刺激性氣味的無色氣體,把Y通入
若Y是有刺激性氣味的無色氣體,把Y通入![]() 溶液中,無現象,然后滴加適量
溶液中,無現象,然后滴加適量![]() 溶液,有白色沉淀生成,則該白色沉淀為 ______ ,試寫出Y與
溶液,有白色沉淀生成,則該白色沉淀為 ______ ,試寫出Y與![]() 溶液反應的化學方程式: ______ ;
溶液反應的化學方程式: ______ ;
![]() 若Z是紅棕色氣體,則
若Z是紅棕色氣體,則![]() 的反應中氧化劑與還原劑物質的量之比為 ______ .
的反應中氧化劑與還原劑物質的量之比為 ______ .
【答案】第三周期第ⅥA族 ![]()

![]() Cl bde
Cl bde ![]()
![]() 1:2
1:2
【解析】
A元素原子有三個電子層,K、M層電子數之和等于L層電子數,則其M層電子數![]() ,故A為硫;B在短周期中金屬性最強,則B為Na;常溫下C單質為雙原子分子,氫化物的水溶液呈堿性,則C為氮元素;D元素最高正價是
,故A為硫;B在短周期中金屬性最強,則B為Na;常溫下C單質為雙原子分子,氫化物的水溶液呈堿性,則C為氮元素;D元素最高正價是![]() 價,且為短周期元素,故D為Cl.
價,且為短周期元素,故D為Cl.
![]() 為S元素,原子核外有3個電子層、最外層電子數為6,處于周期表中第三周期第ⅥA族,故答案為:第三周期第ⅥA族;
為S元素,原子核外有3個電子層、最外層電子數為6,處于周期表中第三周期第ⅥA族,故答案為:第三周期第ⅥA族;
![]() 單質為
單質為![]() ,分子中氮原子之間形成3對共用電子對,電子式為
,分子中氮原子之間形成3對共用電子對,電子式為![]() ,故答案為:
,故答案為:![]() ;
;
![]() 原子核外電子數為17,原子結構示意圖為
原子核外電子數為17,原子結構示意圖為 ,故答案為:
,故答案為: ;
;
![]() 屬于離子化合物,鈉原子與硫原子的電子式表示硫化鈉的形成過程為:
屬于離子化合物,鈉原子與硫原子的電子式表示硫化鈉的形成過程為:![]() ,
,
故答案為:![]() ;
;
![]() 元素非金屬性比硫的強,
元素非金屬性比硫的強,
![]() 常溫下單質的狀態屬于物理性質,不能用以判斷非金屬性的強弱,故a錯誤;
常溫下單質的狀態屬于物理性質,不能用以判斷非金屬性的強弱,故a錯誤;
![]() 的氫化物比A的氫化物穩定,說明D的非金屬性較強,故b正確;
的氫化物比A的氫化物穩定,說明D的非金屬性較強,故b正確;
![]() 一定條件下D和A的單質都能與鈉反應,說明都具有氧化性,但不能說明非金屬性的強弱,故c錯誤;
一定條件下D和A的單質都能與鈉反應,說明都具有氧化性,但不能說明非金屬性的強弱,故c錯誤;
![]() 的最高價含氧酸酸性弱于D的最高價含氧酸,說明D的非金屬性較強,故d正確;
的最高價含氧酸酸性弱于D的最高價含氧酸,說明D的非金屬性較強,故d正確;
![]() 單質能與A的氫化物反應生成A單質,說明D的非金屬性較強,故e正確.
單質能與A的氫化物反應生成A單質,說明D的非金屬性較強,故e正確.
故答案為:Cl:bde;
![]() 是由S、Na、N、Cl四種元素中的某種元素組成的單質,
是由S、Na、N、Cl四種元素中的某種元素組成的單質,
![]() 若Y是有刺激性氣味的無色氣體,硫元素單質化合物性質符合,可推知X為硫、Y為
若Y是有刺激性氣味的無色氣體,硫元素單質化合物性質符合,可推知X為硫、Y為![]() 、Z為
、Z為![]() 、W為
、W為![]() ,
,![]() 通入
通入![]() 溶液中,然后滴加適量
溶液中,然后滴加適量![]() 溶液,
溶液,![]() 被氧化性為硫酸,發生反應:
被氧化性為硫酸,發生反應:![]() ,硫酸與氯化鋇反應生成硫酸鋇與鹽酸,白色沉淀為
,硫酸與氯化鋇反應生成硫酸鋇與鹽酸,白色沉淀為![]() ,該反應的化學方程式為:
,該反應的化學方程式為:![]() ,
,
故答案為:![]() ;
;![]() ;
;
![]() 若Z是紅棕色氣體,則Z為
若Z是紅棕色氣體,則Z為![]() ,則X為
,則X為![]() 、Y為NO、W為
、Y為NO、W為![]() ,則
,則![]() 的反應為
的反應為![]() ,反應中二氧化氮是氧化劑、還原劑,起氧化劑的二氧化氮生成NO,起還原劑的二氧化氮生成硝酸,故氧化劑與還原劑物質的量之比
,反應中二氧化氮是氧化劑、還原劑,起氧化劑的二氧化氮生成NO,起還原劑的二氧化氮生成硝酸,故氧化劑與還原劑物質的量之比![]() :2,
:2,
故答案為:1:2.


科目:高中化學 來源: 題型:
【題目】現有部分元素的原子結構特點如表,下列敘述中正確的是
A.W原子結構示意圖為![]()
B.元素X和Y只能形成原子個數比為1∶2的化合物
C.元素X比元素Z的非金屬性強
D.X、Y、Z、W四種元素不能形成離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知SiO2+2C![]() Si+2CO↑;Si+C
Si+2CO↑;Si+C![]() SiC。
SiC。
現有石英砂和炭粉的混合物1mol,于高溫下在電爐里充分反應后,得殘留固體;若石英砂與混和物的物質的量之比n(0<n<1),試討論n取何值時,殘留物的成分及其物質的量。
n | 例︰n= | __ | __ | __ | __ |
殘留固體及物質的量(摩) | Si | __ | __ | __ | __ |
___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著我國汽車年銷量的大幅增加,給空氣環境造成了很大的污染。汽車尾氣裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )

A. 反應中NO為氧化劑,N2為氧化產物
B. 汽車尾氣的主要污染成分包括CO、NO和N2
C. NO和O2必須在催化劑表面才能反應
D. 催化轉化總化學方程式為2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質,不能按 ![]() (“→”表示反應一步完成)關系轉化的是( )
(“→”表示反應一步完成)關系轉化的是( )
選項 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如右圖所示,將鐵棒和石墨棒插入盛有飽和NaCl溶液的U型管中。下列分析正確的()
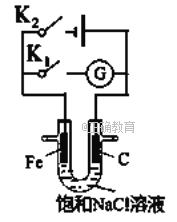
A. K1閉合,鐵棒上發生的反應為2H++2e-=H2↑
B. K1閉合,石墨棒周圍溶液堿性增強
C. K2閉合,鐵棒不會被腐蝕,屬于犧牲陽極的陰極保護法
D. K2閉合,電路中通過0.002NA個電子時,兩極共產生0.001mol氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀是一種重要的化工原料,一般由鉻鐵礦制備,鉻鐵礦的主要成分為FeO·Cr2O3,還含有硅、鋁等雜質。制備流程如圖所示:

回答下列問題:
(1)步驟①的主要反應為:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反應配平后FeO·Cr2O3與NaNO3的系數比為__________。該步驟不能使用陶瓷容器,原因是________________。
(2)濾渣1中含量最多的金屬元素是____________,濾渣2的主要成分是_____________及含硅雜質。
(3)步驟④調濾液2的pH使之變____________(填“大”或“小”),原因是___________________(用離子方程式表示)。
(4)有關物質的溶解度如圖所示。向“濾液3”中加入適量KCl,蒸發濃縮,冷卻結晶,過濾得到K2Cr2O7固體。冷卻到___________(填標號)得到的K2Cr2O7固體產品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步驟⑤的反應類型是___________________。
(5)某工廠用m1 kg 鉻鐵礦粉(含Cr2O3 40%)制備K2Cr2O7,最終得到產品 m2 kg,產率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖中A~H均為中學化學中常見的物質,A、B、H為氣體,反應①是重要的工業反應,它們之間有如下轉化關系(反應中生成的水已略去)。

請回答以下問題:
(1)B是_____,D是_____,G是_____,H是_____(填化學式)。
(2)工業上常利用反應①制取漂白粉,該反應的化學方程式:__________,漂白粉溶于水后,受空氣中的CO2作用,即產生有漂白、殺菌作用的次氯酸,化學反應方程式為_________。
(3)A中元素的原子結構示意圖為________。
(4)F在溶液中的電離方程式為_________。
(5)上述反應中屬于氧化還原反應的是_______(填寫序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組利用以下實驗裝置模擬工業煉鐵的主要過程:
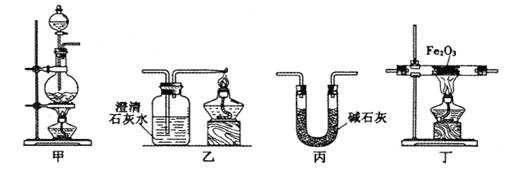
(1)裝置甲中發生的反應為:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一種無色有刺激性氣味的液體。制取一氧化碳時應該______________(填字母)。
CO↑+H2O。已知甲酸是一種無色有刺激性氣味的液體。制取一氧化碳時應該______________(填字母)。
a.將甲酸滴入濃硫酸 b.將濃硫酸滴入甲酸 c.將甲酸與濃硫酸混合后加入
(2)請按合適的順序連接好以下裝置:甲→(_____)→(_____)→(_____)
(3)丙裝置中堿石灰的作用是__________________________。
(4)實驗將近完成時,熄滅裝置甲、乙、丁中酒精燈的先后順序為__________。
(5)為了探究影響反應產物的外界因素,在Fe2O3,與CO反應部位,該小組同學分別用酒精燈和酒精噴燈進行了兩次實驗,結果如下:
加熱方式 | 通CO加熱時間/min | 澄清石灰水變渾濁時間/min | 產物顏色 | 產物能否全部被磁鐵吸引 |
酒精燈 | 30 | 5 | 黑色 | 能 |
酒精噴燈 | 30 | 1 | 黑色 | 能 |
①甲同學猜想黑色產物中可能含有碳單質。乙同學排除了該可能,他提出的兩種理由是:____、____。
②丙同學查找資料發現,Fe3O4也能被磁鐵吸引,對黑色產物成分提出以下三種假設:i.全部為鐵;ii.________;iii.___________。
③通過進一步定量實驗,黑色產物所含元素組成和質量分數如下:
樣品序號 | 加熱方式 | 元素組成和質量分數 |
產物樣品I | 酒精燈 | w(Fe)=74.4%、w(O)=25.6% |
產物樣品II | 酒精噴燈 | w(Fe)=100% |
樣品I的成分及質量分數為______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com