
(6分)現有①NaCl晶體 ②液態SO3 ③液態的醋酸 ④鋁 ⑤BaSO4固體 ⑥純蔗糖(C12H22O11)⑦酒精(C2H5OH) ⑧熔化的KNO3,請回答下列問題(填序號)
(1)屬于電解質的是 。
(2)屬于非電解質的是 。
(3)能導電的是 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016屆安徽省等六校教研會高三第一次聯考化學試卷(解析版) 題型:選擇題
根據原子結構及元素周期律的知識,下列推斷正確的是
A、同主族元素含氧酸的酸性隨核電荷數的增加而減弱
B、核外電子排布相同的微粒化學性質也相同
C、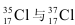 得電子能力相同
得電子能力相同
D、F-、O2-、Mg2+、Na+半徑逐漸減小
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧育才學校高一上第一次階段測化學試卷(解析版) 題型:選擇題
某不純的鐵片可能含有Mg、Al、Cu等金屬雜質的一種或幾種,取該鐵片樣品5.6g與足量的稀硫酸反應,得到標準狀況下的H2 2.24L,則下列分析的結論中,正確的是
A.一定同時含有三種金屬雜質 B.一定不含有雜質銅
C.一定含有雜質鎂 D.可能同時含有雜質鎂.鋁或其中一種
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三上學期四調考試化學試卷(解析版) 題型:實驗題
(10分)實驗室利用硫酸廠燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)制備聚鐵(堿式硫酸鐵的聚合物)和綠礬(FeSO4·7H2O),過程如下:
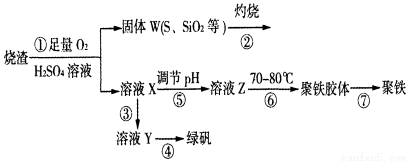
(1)將過程②中的產生的氣體通入下列溶液中,溶液會褪色的是 ;
A.品紅溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)過程①中,FeS和O2、H2SO4反應的離子方程式為: ;
(3)過程③中,需加入的物質是 ;
(4)實驗室為測量所得到的聚鐵樣品中鐵元素的質量分數,進行下列實驗。①用分析天平稱取2.800g樣品;②將樣品溶于足量的鹽酸后,加入過量的氯化鋇溶液;③過濾、洗滌、干燥,稱量,得固體質量為3.495g。若該聚鐵主要成分為[(Fe(OH)(SO4)]n,則該聚鐵樣品中鐵元素的質量分數為 。(假設雜質中不含鐵元素和硫元素)。
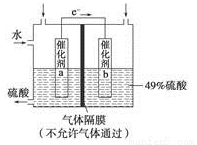
(5)下圖是將過程②產生的氣體SO2轉化為重要的化工原料H2SO4的原理示意圖,若得到的硫酸濃度仍為49%,則理論上參加反應的SO2與加入的H2SO4的質量比為___________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省高二上10月月考化學試卷(解析版) 題型:選擇題
下列各組原子中,彼此化學性質一定相似的是
A.原子核外電子排布式為1s2的X原子與原子核外電子排布式為1s22s2的Y原子
B.原子核外M層上僅有兩個電子的X原子與原子核外N層上僅有兩個電子的Y原子
C.2p軌道上有三個未成對的電子的X原子與3p軌道上有三個未成對的電子的Y原子
D.最外層都只有一個電子的X、Y原子
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三上學期第一次模擬化學試卷(解析版) 題型:填空題
(15分)原子序數依次增大的四種元素A、B、C、D分別處于第一至第四周期,自然界中存在多種A的化合物,B原子核外電子有6種不同的運動狀態,B與C可形成正四面體形分子,D的基態原子的最外能層只有一個電子,其他能層均已充滿電子。請回答下列問題:
(1)這四種元素中電負性最大的元素,其基態原子的價電子排布圖為 ,第一電離能最小的元素是 (填元素符號)。
(2)C所在主族的前四種元素分別與A形成的化合物,沸點由高到低的順序是 (填化學式),呈現如此遞變規律的原因是 。
(3)B元素可形成多種單質,一種晶體結構如圖一所示,其原子的雜化類型為 、另一種的晶胞如圖二所示,該晶胞的空間利用率為 ,若此晶胞中的棱長為356.6 pm,則此晶胞的密度為 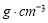 (保留兩位有
(保留兩位有 效數字)。(
效數字)。(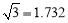 )
)
(4)D元素形成的單質,其晶體的堆積模型為 ,D的醋酸鹽晶體局部結構如圖三,該晶體中含有的化學鍵是 (填選項序號)。
①極性鍵 ②非極性鍵 ③配位鍵 ④金屬鍵
(5)向D的硫酸鹽溶液中滴加過量氨水,觀察到的現象是 。請寫出上述過程的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅蘭州一中高二上期中測試理科化學試卷(解析版) 題型:選擇題
某同學按照課本實驗要求,用50 mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的NaOH 溶液在右圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算中和熱。下列說法中,正確的是

A.實驗過程中沒有熱量損失
B.圖中實驗裝置缺少環形玻璃攪拌棒
C.燒杯間填滿碎紙條的作用是固定小燒杯
D.若將鹽酸體積改為60 mL,理論上所求中和熱不相等
查看答案和解析>>
科目:高中化學 來源:2014-2015學年山東省濟南外國語學校高三上學期期中測試化學試卷(解析版) 題型:選擇題
下列各反應的離子方程式書寫中,正確的是
A.金屬鈉投入水中:Na+2H2O═Na++OH-+H2↑
B.用FeCl3溶液腐蝕銅線路板:Cu+Fe3+═Cu2++Fe2+
C.向Na2CO3溶液中加入過量CH3COOH溶液:CO32-+2H+═CO2↑+H2O
D.過量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古巴彥淖爾高二上10月月考化學試卷(解析版) 題型:選擇題
在盛有足量A的體積可變的密閉容器中,保持壓強一定,加入B,發生反應:A(s)+2B(g)?4C(g)+D(g);△H<0.在一定溫度、壓強下達到平衡.平衡時C的物質的量與加入的B的物質的量的變化關系如圖.下列說法正確的是
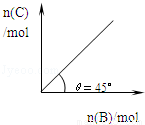
A. 若當溫度升高后,則圖中θ>45°
B. 若再加入B,則正、逆反應速率均逐漸增大
C. 若再加入B,則再次達到平衡時反應體系氣體密度減小
D. 平衡時B的轉化率為50%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com