
利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污泥中Cr(III)的處理工藝如下:

其中硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)實驗室用18.4 mol·L―1的濃硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃儀器除燒杯、玻璃棒和膠頭滴管外,還需 。
(2)酸浸時,為了提高浸取率可采取的措施有 、
。(寫出兩個措施)
(3)H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72―,寫出此反應的離子方程式:
。
(4)常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
|
陽離子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
|
開始沉淀時的pH |
2.7 |
—— |
—— |
—— |
|
沉淀完全時的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈堿性,Cr2O72―轉化為CrO42―。濾液Ⅱ中陽離子主要有 ;但溶液的pH不能超過8,其理由是 。
(5)鈉離子交換樹脂的反應原理為:Mn++nNaR→MRn+nNa+,利用鈉離子交換樹脂除去濾液Ⅱ中的金屬陽離子是 。
(6)寫出上述流程中用SO2進行還原的化學方程式 。
(1)250mL容量瓶(1分)、量筒(1分)
(2)升高反應溫度、增大固體顆粒的表面積、加快攪拌速度等(3點中答到2點即給2分)
(3)2Cr3+ + 3H2O2 + H2O = Cr2O72—+ 8H+(2分)
(4)Na+、Mg2+、Ca2+(2分)
pH超過8會使部分Al(OH)3溶解生成AlO2-,最終影響Cr(III)回收與再利用(2分)
(5)Ca2+、Mg2+(2分)
(6)3SO2 + 2Na2CrO4 + 12H2O = 2CrOH(H2O)5SO4↓+ Na2SO4 + 2NaOH (2分,
或3SO2 + 2CrO42- + 12H2O = 2CrOH(H2O)5SO4↓+ SO42- + 2OH-)
【解析】(1)考查物質的量濃度的配制。根據所給的儀器可知,好缺少250ml容量瓶和量筒。
(2)考查外界條件對反應速率的影響。可從溫度,濃度和接觸面積等角度進行考慮。
(3)考查氧化還原反應方程式的配平,依據得失電子守恒進行配平。
(4)根據沉淀時的pH值可以判斷,當pH=8時,溶液中的Fe3+、Al3+已經以氫氧化物沉淀的形成析出,溶液中的陽離子主要還有Na+、Mg2+、Ca2+。因為pH太高,會溶解氫氧化鋁沉淀,影響其后續實驗的分離和提純。
(5)根據鈉離子交換樹脂的反應原理可知,濾液中的Ca2+、Mg2+將被交換而除去。
(6)根據物質反應前后的變化可知二氧化硫是用來還原溶液中的CrO42―,其還原產物是CrOH(H2O)5SO4,然后根據得失電子守恒配平即可。


科目:高中化學 來源: 題型:閱讀理解
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 開始沉淀時的pH | 2.7 | -- | -- | -- |
| 沉淀完全時的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 | 2 |
查看答案和解析>>
科目:高中化學 來源:江蘇省2010屆高三年級第一次模擬考試化學試題 題型:填空題
(10分)利用化學原理可以對工廠排放的廢水進行有效檢測和合理處理。
(1)染料工業排放的廢水中含有大量有毒的NO2-,可以在堿性條件下加入鋁粉除去(加熱處理后的廢水會產生能使濕潤紅色石蕊試紙變藍的氣體)。除去NO2-離子的離子方程式是
▲ 。
(2)廢水中的N、P元素是造成水體富營養化的主要因素,農藥廠排放的廢水中常含有較多的NH4+和PO43-,一般可以通過兩種方法將其除去。
①方法一:將Ca(OH)2或CaO投加到待處理的廢水中,生成磷酸鈣,從而進行回收。當處理后的廢水中c(Ca2+)=2×10-7mol/L時,溶液中c(PO43-)= ▲
(已知常溫時,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在廢水中加入鎂礦工業廢水,就可以生成高品位的磷礦石——鳥糞石,反應的方程式為Mg2++ NH4++ PO43-= MgNH4 PO4。該方法中需要控制污水的pH為7.5-10,若pH高于10.7,鳥糞石的產量會大大降低。其原因可能是 ▲ 。與方法一相比,方法二的優點是 ▲ 。
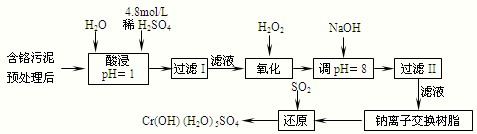
(3)三氯乙烯在印刷、紡織等行業應用廣泛,為了減少其對環境的影響,可將三氯乙烯在二氧化鈦薄膜上催化降解,其反應的機理如下:

該反應的總化學方程式為 ▲ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com