
| A. | 離子半徑X>Y>Z | |
| B. | 元素原子得電子能力X>Y>Z | |
| C. | 最高價氧化物對應水化物的酸性強弱X>Y>Z | |
| D. | 單質與氫氣反應,X、Y、Z難度依次增大 |
分析 電子層數相同的三種元素X、Y、Z,說明它們屬于同一周期元素,同一周期元素,非金屬性隨著原子序數增大而增強,元素的非極性越強,其氫化物的穩定性越強,因為它們的氣態氫化物穩定性順序為HX>H2Y>H3Z,所以原子序數X>Y>Z,非金屬性X>Y>Z,
A.電子層結構相同的離子,離子半徑隨著原子序數增大而減小;
B.元素的非金屬性越強,其原子得電子能力越強;
C.元素的非極性越強,其最高價氧化物的水化物酸性越強,但O、F元素除外;
D.元素的非金屬性越強,其單質與氫氣越容易化合.
解答 解:電子層數相同的三種元素X、Y、Z,說明它們屬于同一周期元素,同一周期元素,非金屬性隨著原子序數增大而增強,元素的非極性越強,其氫化物的穩定性越強,因為它們的氣態氫化物穩定性順序為HX>H2Y>H3Z,所以原子序數X>Y>Z,非金屬性X>Y>Z,
A.電子層結構相同的離子,離子半徑隨著原子序數增大而減小,所以離子半徑X<Y<Z,故A錯誤;
B.元素的非金屬性越強,其原子得電子能力越強,非金屬性X>Y>Z,所以元素原子得電子能力X>Y>Z,故B正確;
C.元素的非極性越強,其最高價氧化物的水化物酸性越強,但O、F元素除外,如果X是F、Y是O元素,二者沒有最高價氧化物的水化物,故C錯誤;
D.元素的非金屬性越強,其單質與氫氣越容易化合,非金屬性X>Y>Z,所以單質與氫氣反應X、Y、Z難度依次增大,故D正確;
故選AC.
點評 本題考查原子結構和元素周期律,為高頻考點,明確同一周期原子結構和元素周期律的關系是解本題關鍵,注意規律中的反常現象,易錯選項是C,O、F元素沒有最高價氧化物的水化物,


科目:高中化學 來源: 題型:填空題
| 金屬離子 | PH值 | |
| 開始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
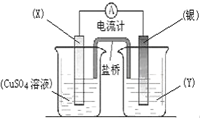 依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.
依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微粒半徑:K+>Al3+>S2->Cl- | B. | 離子的還原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金屬性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 呈中性 | B. | 呈堿性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO(g)+H2(g).
CO(g)+H2(g).| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在離核較遠區域的電子易失去,其原因是這些電子的能量較高 | |
| C. | 通過化學變化可以實現16O與18O間的相互轉化 | |
| D. | 對于吸收能量的反應必需加熱才能發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 穩定性:A2D<A2X | |
| B. | CA3分子的立體結構為平面三角形 | |
| C. | C形成的單質中σ鍵與π鍵個數之比為1:2 | |
| D. | B、C、D形成的氣態氫化物互為等電子體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com