
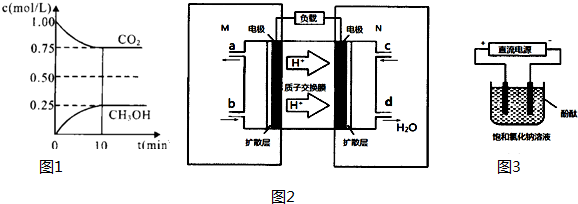
分析 (1)①化學(xué)反應(yīng)達(dá)到化學(xué)平衡狀態(tài)時(shí),正逆反應(yīng)速率相等,且不等于0,各物質(zhì)的濃度不再發(fā)生變化,由此衍生的一些物理量不發(fā)生變化,以此進(jìn)行判斷;
②要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$ 增大,則根據(jù)反應(yīng),平衡向正反應(yīng)方向移動(dòng)即可;
③根據(jù)圖象數(shù)據(jù)結(jié)合平衡常數(shù)K的計(jì)算公式進(jìn)行計(jì)算,根據(jù)K僅與溫度有關(guān)及反應(yīng)為放熱來判斷改變條件;
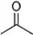
(2)①首先根據(jù)氫離子的移動(dòng)方向來確定正負(fù)極,然后根據(jù)原電池原理書寫電極反應(yīng)式;
②整個(gè)電路中轉(zhuǎn)移電子的數(shù)目相等,可以根據(jù)電子轉(zhuǎn)移的數(shù)目相同來列出已知物質(zhì)和未知物質(zhì)之間關(guān)系式,然后通過關(guān)系來求解;
解答 解:(1)①A.CO2的體積分?jǐn)?shù)在混合氣體中保持不變,則能說明達(dá)到平衡狀態(tài),故A正確;
B.密度=$\frac{總質(zhì)量}{體積}$,總質(zhì)量一定,體積一定,故密度一定,故混合氣體的密質(zhì)不再發(fā)生改變不能說明達(dá)到平衡狀態(tài),故B錯(cuò)誤;
C.單位時(shí)間內(nèi)每消耗1.2mol H2,同時(shí)生成0.4molH2O,不能體現(xiàn)正逆反應(yīng),故不能說明達(dá)到平衡狀態(tài),故C錯(cuò)誤;
D.H2O與CH3OH都是產(chǎn)物,并且按照1:1的比例生成,所以H2O與CH3OH的物質(zhì)的量濃度之比一直為1:1,不能說明達(dá)到平衡狀態(tài),故D錯(cuò)誤;
故選A;
②要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,則根據(jù)反應(yīng),
A.升高溫度,平衡逆向移動(dòng),所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$減小,故A錯(cuò)誤;
B.恒溫恒容下充入He(g),平衡不移動(dòng),所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不變,故B錯(cuò)誤;
C.將H2O(g)從體系中分離,平衡正向移動(dòng),所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正確;
D.恒溫恒容再充入2mol CO2和3mol H2,等效于開始加入4molCO2和6molH2,壓強(qiáng)增大,平衡正向移動(dòng),所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正確;
故選:CD;
③由圖象數(shù)據(jù)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
開始濃度:1 1.5 0 0
轉(zhuǎn)化濃度:0.25 0.75 0.25 0.25
平衡濃度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,則要使K=1,又反應(yīng)放熱所以降低溫度使平衡向正反應(yīng)方向移動(dòng),故答案為:0.20;C;
(2)①M(fèi)區(qū)是質(zhì)子流出的一極,應(yīng)是原電池的負(fù)極,發(fā)生氧化反應(yīng),電極反應(yīng)式為:CH3OH-6e-+H2O=CO2+6H+,
故答案為:CH3OH-6e-+H2O=CO2+6H+;
②用惰性電極,電解飽和食鹽水總的電極反應(yīng)式為2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH-,
pH值變?yōu)?3時(shí),pOH=1,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.3L=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH-可知
CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
則m(CH3OH)=32g×0.03mol÷6mol=0.16g,
故答案為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH-;0.16g;
點(diǎn)評(píng) 本題考查了化學(xué)平衡的有關(guān)知識(shí),電極反應(yīng)式的書寫等,綜合性強(qiáng),但難度不大.


 快捷英語周周練系列答案
快捷英語周周練系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:解答題
 ,根據(jù)鍵線式回答下列問題:
,根據(jù)鍵線式回答下列問題: 分子式:C5H9O2,結(jié)構(gòu)簡式:CH2=CH(CH3)COOCH3.
分子式:C5H9O2,結(jié)構(gòu)簡式:CH2=CH(CH3)COOCH3. .
. +3HNO3$→_{△}^{濃硫酸}$
+3HNO3$→_{△}^{濃硫酸}$ +3H2O.
+3H2O.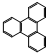 的一氯取代物有2種,
的一氯取代物有2種, 的二氯取代物有7種.
的二氯取代物有7種.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| 選項(xiàng) | 第I欄 | 第Ⅱ欄 | 第Ⅲ欄 |
| A | 往少量NaOH溶液中投入鋁片 | 往過量NaOH溶液中投入鋁片 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氫氧化鈉溶液 | 往Fe2(SO4)3溶液中滴入氫氧化鋇溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| D | 往NaOH溶液中通入過量CO2氣體 | 往NaOH溶液中通入少量CO2氣體 | CO2+OH-═HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 碳?xì)滏I的鍵能相等 | B. | 甲烷的二氯代物的結(jié)構(gòu)只一種 | ||
| C. | 四個(gè)碳?xì)滏I的鍵長相等 | D. | 甲烷的一氯代物只有一種 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| 序號(hào) | 操作及現(xiàn)象 | 結(jié)論 |
| A | 將0.1 mol•L-1氨水稀釋成0.01 mol•L-1,測(cè)得 pH由11.1變成 10.6 | 稀釋后NH3•H2O的電離程度減小 |
| B | 常溫下,測(cè)得飽和Na2CO3溶液的pH大于 飽和NaHCO3溶液 | 常溫下水解程度: CO32->HCO3- |
| C | 向25 mL冷水和沸水中分別滴入5滴FeCl3飽和溶液,前者為黃色,后者為紅褐色 | 溫度升高,F(xiàn)e3+的水解程度增大 |
| D | 溴乙烷與NaOH乙醇溶液共熱產(chǎn)生的氣體 通入KMnO4酸性溶液中,溶液褪色 | 產(chǎn)生的氣體為乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
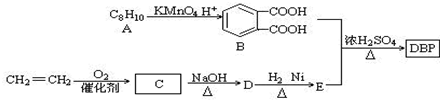
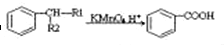
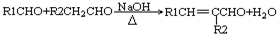 (-R1、-R2表示氫原子或烴基)
(-R1、-R2表示氫原子或烴基)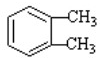 ,D的結(jié)構(gòu)簡式是CH3CH=CHCHO,D→E的反應(yīng)類型加成(還原)反應(yīng);
,D的結(jié)構(gòu)簡式是CH3CH=CHCHO,D→E的反應(yīng)類型加成(還原)反應(yīng);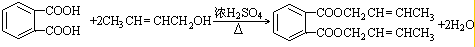 ;
;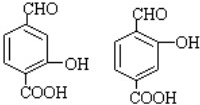 ;
;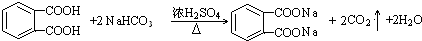 .
.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
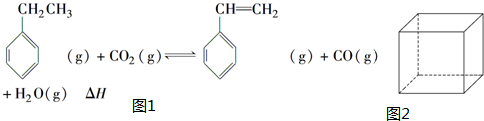
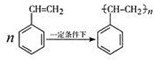 .立方烷(C8H8)的鍵線式結(jié)構(gòu)如圖2所示,它和苯乙烯的關(guān)系是同分異構(gòu)體(填“同位素”、“同素異形體”、“同分異構(gòu)體”或“同系物”).
.立方烷(C8H8)的鍵線式結(jié)構(gòu)如圖2所示,它和苯乙烯的關(guān)系是同分異構(gòu)體(填“同位素”、“同素異形體”、“同分異構(gòu)體”或“同系物”).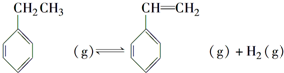 △H1=+117.6kJ•mol-1
△H1=+117.6kJ•mol-1查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題

查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
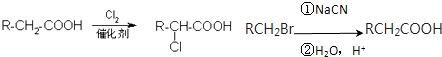
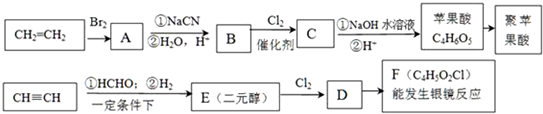
 .
.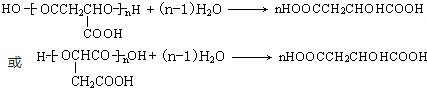 .
.查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com