
一定溫度下,將3molA氣體和1molB氣體通過一密閉容器中,發生如下反應: 3A(g)+B (g) xC(g)。若容器體積固定為2L,反應1min時測得剩余1.8molA,C的濃度為0.4mol/L。請填寫下列空白:
xC(g)。若容器體積固定為2L,反應1min時測得剩余1.8molA,C的濃度為0.4mol/L。請填寫下列空白:
(1) x= ; 1min內,B的平均反應速率為_________;
(2)若反應經2min達到平衡,平衡時C的濃度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的體積分數為22%,若維持容器壓強不變,達到平衡時C的體積分數_________22%,(填“大于”、“等于”或“小于”);
(4)若改變起始物質加入的量,欲使反應達到平衡時C的物質的量分數與原平衡相等,起始加入的三種物質的物質的量n(A)、n (B)、n(C)之間應滿足的關系式__________________ 。
(1)2 0.2 mol/(L·min); (2) 小于
(3)大于 (4)n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
解析試題分析:
3A(g) + B (g)  xC(g)
xC(g)
起始 3 1 0
轉化 1.2 0.4 0.4×2=0.8
1min 1.8 0.6
所以x=2 B的平均反應速率為0.2 mol/(L·min)
(2)1min是C的濃度為0.4mol/L,2min平衡時隨反應濃度降低,反應速率減慢,因此C的濃度小于0.8 mol/L。
(3)若維持容器壓強不變,需要縮小容器體積,有利于反應正向移動,因此C的體積分數大于22%。
(4)根據等效平衡原理,需要滿足:n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
考點:考查了化學平衡移動和計算。


科目:高中化學 來源: 題型:填空題
Ⅰ.(4分)在一體積為10L密閉的容器中,通入一定量的CO和H2O(g),在850℃時發生如下反應:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O濃度變化如圖,則0~4 min的平均反應速率ν(CO)=_______ mol/(L·min),此時該反應的平衡常數為 。 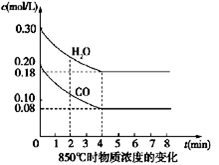
(2)當下列哪些物理量不再發生變化時,表明上述反應已達到平衡狀態的是 。
| A.混合氣體的壓強 |
| B.混合氣體的密度 |
| C.CO的物質的量濃度 |
| D.密閉容器中放出熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有可逆反應:mA(g)+nB(g)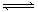 pC(g)+ qD(g);根據下圖示回答:
pC(g)+ qD(g);根據下圖示回答: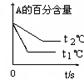
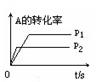
(1)左圖中溫度t1℃ t2℃(填“高于”或“低于”)
(2)該反應的正反應為 反應(填“吸熱”或“放熱”)
(3)右圖中壓強 p1 p2(填“>”、“<”、“=”)
(4)反應式中(m +n) (p +q)(填“>”、“<”、“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取乙醇的反應: 2CO2(g)+6H2(g)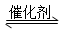 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密閉容器中,按H2與CO2的物質的量之比為3:1進行投料,在5MPa下測得不同溫度下平衡體系中各種物質的體積分數(y%)如下圖所示。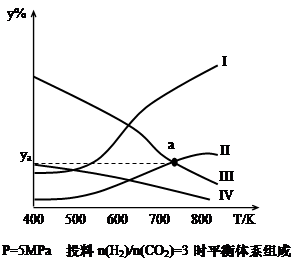
完成下列填空:
(1)表示CH3CH2OH體積分數曲線的是_______(選填序號)
(2)在一定溫度下反應達到平衡的標志是_______(選填編號)
a.平衡常數K不再增大
b.CO2的轉化率不再增大
c.混合氣體的平均相對分子質量不再改變
d.反應物不再轉化為生成物
(3)其他條件恒定,如果想提高CO2的反應速率,可以采取的反應條件是_______(選填編號);達到平衡后,能提高H2轉化率的操作是_______(選填編號)
a.降低溫度 b.充入更多的H2
c.移去乙醇 d.增大容器體積
(4)圖中曲線II和III的交點a對應的體積分數ya=_______%
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
300℃時,將2mol A和2mol B兩種氣體混合于2L密閉容器中,發生如下反應:3A(g)+B(g) 2C(g)+2D(g) △H,2min末達到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末達到平衡,生成0.8mol D。
(1)在2min末時,A的平衡濃度為_____________,B的轉化率___________,0-2min內D的平均反應速率為_____________。
(2)該反應的平衡常數表達式為:K=_____________。該溫度下的化學平衡常數數值為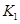 =____________。
=____________。
已知350℃時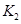 =l,則△H________0(填“>”或“<”)。
=l,則△H________0(填“>”或“<”)。
(3)在300℃時,將該反應容器壓縮體積為lL。則A的轉化率___________(填“增大”、“減小”或“不變”),原因是__________________。該條件下的平衡常數為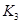 。 則K3________
。 則K3________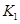 ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判斷該反應是否達到化學平衡狀態的依據是__________________(多選扣分)。
A.容器中壓強不變 B.混合氣體中c(A)不變
C.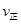 (A)=
(A)=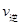 (C) D.混合氣體密度不變
(C) D.混合氣體密度不變
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g) CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
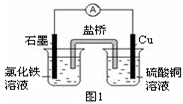
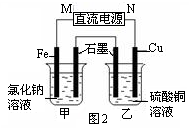
鐵及其化合物在生產、生活中應用廣泛。
(1)一定條件下,Fe與CO2可發生反應:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
該反應的平衡常數(K ) 隨溫度(T ) 升高而增大。
①該反應的平衡常數K=______。(填表達式)
②下列措施中,能使平衡時c(CO)/c(CO2) 增大的是 (填標號)。
| A.升高溫度 | B.增大壓強 |
| C.充入一定量CO | D.再加一些鐵粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是重要的化工原料和清潔液體燃料。工業上可利用CO或CO2來生產甲醇。甲醇制
備的相關信息如下表: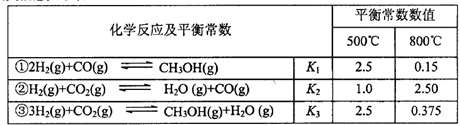
(1)反應②是____反應(選填“吸熱”“放熱”)。
(2)據上表信息推導出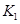 、
、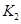 與
與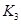 之間的關系,
之間的關系,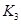 =______用
=______用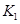 、
、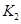 表示)。500℃時測得反應③在某時刻,
表示)。500℃時測得反應③在某時刻,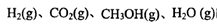 的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時
的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時 (選填“>”“<”“=”)。
(選填“>”“<”“=”)。
(3)若某溫度下反應①從開始到平衡CO和CH3OH的濃度變化如圖一所示,則用H2濃度變化表示此段時間內該反應的平均速.v(H2)= 若某溫度下反應①中H2的平衡轉化率(a)與體系總壓強(P)的關系如圖二所示,則平衡狀態由A變到B時,平衡常數 (選填“>”“<”“=”)。
(選填“>”“<”“=”)。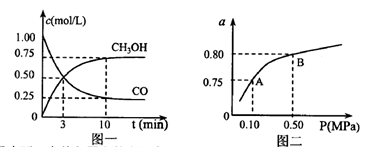
(4)一定溫度下,在體積固定的密閉容器中發生反應②,可判斷該反應已經達到平衡的是____。(用相應字母表示)
| A.容器中總壓強不變 |
| B.混臺氣體的平均摩爾質量也始終保持不變, |
| C.混合氣體的密度不變 |
| D.CO2(g)或CO(g)的濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)常溫下,將2種一元酸分別和NaOH溶液等體積混合,實驗數據如下:
| 組別 | 一元酸 | NaOH | pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 乙 | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
 CH3OH(g) △H
CH3OH(g) △H| 溫度 | 523K | 573K | 623K |
| 平衡常數(K) | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com