
某溫度時,濃度均為1 mol·L-1的兩種氣體X2、Y2,在容積不變的密閉容器中發生反應,反應結束時,容器內各物質的濃度為:c(X2)=0.6 mol·L-1,c(Y2)=1.2 mol·L-1,c(Z)=0.4 mol·L-1。則該反應的化學方程式為( )
A.2X2+Y2====2Z B.X2+Y2====2Z
C.2X2![]() Y2+2Z D.3X2+6Y2====2Z
Y2+2Z D.3X2+6Y2====2Z
科目:高中化學 來源: 題型:閱讀理解
| 容器 | A | B |
| 反應物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)濃度(mol?L-1) | c1 | c2 |
| 反應能量變化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 9.8 | 9.7 | 11.6 | 10.3 |
| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
A.2X2+Y2====2Z B.X2+Y2====2Z
C.2X2![]() Y2+2Z D.3X2+6Y2====2Z
Y2+2Z D.3X2+6Y2====2Z
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江西上饒中學高一零點、實驗班下期末化學試卷(帶解析) 題型:實驗題
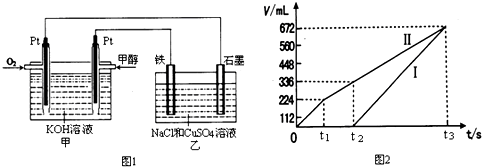
(12分)某研究小組為比較Al和Fe的金屬性強弱,設計了圖1所示的裝置。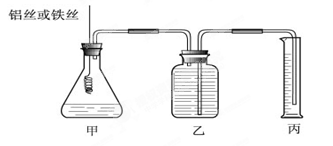
(1)甲中錐形瓶內盛放的液體是_______________________。
(2)若要比較產生氣體的快慢,可以比較相同時間內產生氣體的體積,也可以比較_ 。
(3)為了確保“Al和Fe的金屬活動性不同是導致產生氣體速率不同的唯一原因”,實驗時需要控制好反應條件。實驗時除需保證甲中液體的體積、物質的量濃度和溫度相同外,還需保證___________。
(4)某興趣小組同學利用氧化還原反應:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O設計如下原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為1 mol·L-1,鹽橋中裝有飽和K2SO4溶液.回答下列問題: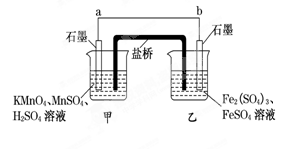
(注:鹽橋常出現在原電池中,是由瓊脂和和K2SO4溶液構成的,用來在兩種溶液中轉移電子。)
(i)發生氧化反應的燒杯是_______ (填“甲”或“乙”).
(ii)外電路的電流方向為:從______到____.(填“a”或“b”)
(iii)電池工作時,鹽橋中的SO移向______(填“甲”或“乙”)燒杯.
(iv)甲燒杯中發生的電極反應式為_________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com