
【題目】關于氰酸銨(NH4CNO)與尿素[CO(NH2)2]的說法正確的是 ( )
A. 都是含極性鍵的共價化合物 B. 都是含非極性鍵的離子化合物
C. 互為同分異構體 D. 互為同系物
科目:高中化學 來源: 題型:
【題目】將a mol Na和amol Al一同投入m g足量水中,所得溶液密度為dg·㎝-3,該溶液的質量分數為
A.82a /(46a + m)%B.82000a /(46a + 2m)%
C.8200a /(46a + m)%D.8200a /(69a +2 m)%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是批量生產的筆記本電腦所用的甲醇燃料電池的結構示意圖。甲醇在催化劑作用下提供質子(H+)和電子。電子經外電路、質子經內電路到達另一極與氧氣反應。電池總反應式為:2CH3OH+3O2=2CO2+4H2O。下列說法中正確的是 ( )

A. 左邊的電極為電池的負極,a處通入的是甲醇
B. 右邊的電極為電池的負極,b處通入的是空氣
C. 電池負極的反應式為:CH3OH+H2O+6e-=CO2+6H+
D. 電池的正極反應式為:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將綠豆大小的方形金屬鈉投入足量且含酚酞的水中,根據相應現象不能得出的結論是( )
選項 | 實驗現象 | 結論 |
A | 方形金屬鈉變成小球 | 鈉與水的反應吸熱 |
B | 鈉浮于水面游動 | 水的密度大于鈉的 |
C | 酚酞溶液變成紅色 | 有堿性物質生成 |
D | 鈉球游動有吱吱聲 | 有氣體生成 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于銅電極的敘述中正確的是
A.用電解法精煉粗銅時純銅作陰極
B.在鐵上電鍍銅時用銅作陰極
C.銅鋅原電池中銅是負極
D.電解稀硫酸時用銅作陽極,陽極產生氧氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用惰性電極電解下列溶液,一段時間后,再加入一定質量的另一物質中(括號內),溶液能與原來溶液完全一樣的是
A.CuSO4[Cu(OH)2]B.NaOH [NaOH]C.NaCl [鹽酸]D.AgNO3[Ag2O]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下按如圖安裝好實驗裝置,在錐形瓶內盛6.5 g鋅粒(顆粒大小基本相同),通過分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,將產生的H2收集在一個注射器中,用時10 s時恰好收集到氣體的體積為50 mL(若折合成0 ℃、101 kPa條件下的H2體積為44.8 mL),在該溫度下,下列說法不正確的是( )
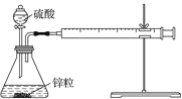
A. 可以通過測定鋅粒減少質量來測定反應速率
B. 忽略錐形瓶內溶液體積的變化,用H+來表示10 s內該反應的速率為0.01 mol·L-1·s-1
C. 忽略錐形瓶內溶液體積的變化,用Zn2+來表示10 s內該反應速率為0.01 mol·L-1·s-1
D. 用H2來表示10 s內該反應的速率為0. 000 2 mol·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了人類的可持續發展,我們應綜合利用資源.保護環境,跟自然 和諧相處:
(1)科學家研制出有“自我修復能力”的塑料.塑料屬于(選填“無機”、“合成”或“復合”)材料,為我們到來了方便,但廢棄塑料處理不當會對環境造成不利的影響,人們把廢棄塑料給環境帶來的危害稱為“”,發電廠是利用垃圾焚燒產生的轉變為電能.
(2)發射“嫦娥三號”的長三甲火箭燃料是偏二甲肼(X),反應的化學方程式為:X+2N2O4=3N2+2CO2+4H2O,則X的化學式為
A.H2
B.CH4
C.C2H8N
D.C2H8N2
(3)2014年3月22日是第二十二個“世界水日”,它的主題是“水與能源”.關于水的知識有下列話題,請按要求填空: ①自來水生產過程中,可用方法除去水中不溶性雜質.
②在生產生活中水是最常用的溶劑,實驗室用蔗糖配制一定溶質質量分數的溶液時,可能涉及以下操作: 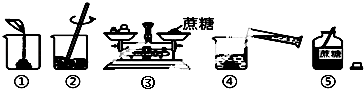
Ⅰ、如圖操作中有錯誤的是(填序號).
Ⅱ、改正錯誤后,表示正確的操作順序是(填序號).
A.⑤②①③④B.⑤①②③④C.⑤③②④①D.⑤③①④②
Ⅲ、保護水環境、珍愛水資源,是每個公民應盡的責任和義務.下列做法不利于保護水資源的是(填序號).
A.大量使用化肥農藥 B.工業廢水處理達標后再排放
C.使用含磷洗衣粉 D.生活污水直接排放.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】焦亞硫酸鈉(Na2S2O5)是一種食品添加劑。實驗室用如圖所示裝置制備Na2S2O5,實驗步驟如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH為4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸鈉粉末至溶液PH為7~8;
Ⅲ.再通入SO2至溶液PH為4.1;
Ⅳ.從過飽和溶液中析出Na2S2O5晶體。
(1)制備焦亞硫酸鈉總反應的化學方程式為___________________ 。
(2)Na2S2O5能與水發生化合反應,反應后所得的溶液顯酸性。用電離方程式表示溶液顯酸性的原因:____________________。
(3)利用碘量法可測定Na2S2O5產品中硫的含量。實驗中必須使用的試劑有c1mol·L-1的標準碘溶液、c2 mol·L-1的標準Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。請補全實驗方案:將一定量的Na2S2O5產品放入碘量瓶(帶磨口塞的錐形瓶)中,加入—定體積的過量c1 mol L-1的標準碘溶液,充分反應后滴入NaOH溶液調節溶液pH至中性,____________________________。重復上述步驟2次,記錄數據。
(4)含鉻酸性廢水中常含有+ 6價鉻。利用Na2S2O5和FeSO4·7H2O分兩個階段先后處理含Cr2O72-的廢水, Cr2O72-被還原為Cr3+,實驗結果如圖。

①0~40 min內用Cr2O72-表示的平均反應速率為____________mol L-1 min-1。
②60~80 min內Cr2O72-與Fe2+發生反應的離子方程式為_________________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com