

分析 (1)黃銅礦廢渣焙燒生成二氧化硫、氧化鐵與CuO;
(2)氧化鐵、氧化銅、二氧化硅混合物用硫酸溶解,二氧化硅不反應,過濾除去;
(3)硫酸銅、硫酸鐵濾液中加入Fe除去硫酸銅,過濾分離,濾液中加入硫酸、過氧化氫得到聚鐵,濾渣B中含有Cu及Fe,利用磁石分離出Fe;
(4)雙氧水不穩定,溫度過高容易分解;
(5)二氧化硫轉化制備的硫酸及濾渣B中的Fe可以循環利用;
(6)根據電子轉移守恒計算過氧化氫的質量,再結合雙氧水的密度與質量分數計算.
解答 解:(1)黃銅礦廢渣焙燒生成二氧化硫、氧化鐵與CuO,反應方程式為:4FeCuS2+13O2$\frac{\underline{\;焙燒\;}}{\;}$8SO2+2Fe2O3+4CuO,
故答案為:4FeCuS2+13O2$\frac{\underline{\;焙燒\;}}{\;}$8SO2+2Fe2O3+4CuO;
(2)氧化鐵、氧化銅、二氧化硅混合物用硫酸溶解,二氧化硅不反應,過濾除去,濾渣A的主要成分為:SiO2,
故答案為:SiO2;
(3)硫酸銅、硫酸鐵濾液中加入Fe除去硫酸銅,過濾分離,濾液中加入硫酸、過氧化氫得到聚鐵,濾渣B中含有Cu及Fe,利用磁鐵吸附分離出Fe,
故答案為:Fe;磁鐵吸附;
(4)控制溫度不能過高,其原因是:溫度過高,雙氧水會分解,工業上此過程應在反應釜中進行,
故答案為:溫度過高,雙氧水會分解;B;
(5)二氧化硫轉化制備的硫酸及濾渣B中的Fe可以循環利用,
故答案為:Fe、H2SO4;
(6)聚鐵中Fe為+3價,根據電子轉移守恒,當生成1mol聚鐵時消耗H2O2為$\frac{2mol×(3-2)}{2}$=1mol,故需要30%H2O2(密度為1.11g/cm3)的體積為:1mol×34g/mol÷30%÷1.11g/cm3=102.1cm3,
故答案為:102.1.
點評 本題考查物質制備工藝流程,涉及對原理與操作的分析評價、條件控制、物質的分離提純、氧化還原反應計算等,熟練掌握元素化合物性質,是對學生綜合能力的考查.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A組 | B組 | C組 | D組 |
| 金剛石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶體:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶體:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知N2和H2在一定條件下發生下列可逆反應:
已知N2和H2在一定條件下發生下列可逆反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
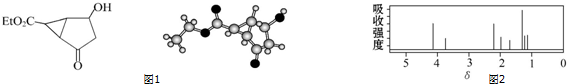
| A. | 該有機物不同化學環境的氫原子有6種 | |
| B. | 該有機物屬于芳香化合物 | |
| C. | 鍵線式中的Et代表的基團為-CH3 | |
| D. | 該有機物在一定條件下能與金屬鈉、乙酸發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
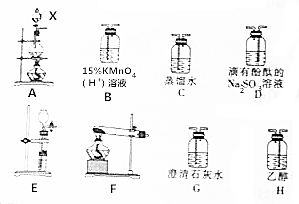 CH3Cl為無色、略帶臭味的氣體,密度為2.25g•L-1,沸點為-23.7℃,難容于水,易溶于乙醇和丙醇等有機溶劑.實驗室將甲醇與濃鹽酸共熱(ZnCl2作催化劑)制備CH3Cl,某化學實驗小組利用下列裝置制備并探究CH3Cl的性質.
CH3Cl為無色、略帶臭味的氣體,密度為2.25g•L-1,沸點為-23.7℃,難容于水,易溶于乙醇和丙醇等有機溶劑.實驗室將甲醇與濃鹽酸共熱(ZnCl2作催化劑)制備CH3Cl,某化學實驗小組利用下列裝置制備并探究CH3Cl的性質.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com