
某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份。向其中一份中逐漸加入銅粉,最多能溶解9.6g。向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如下圖所示(己知硝酸只被還原為NO氣體)。下列分析或結果錯誤的是
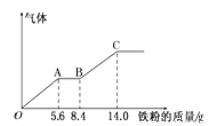
A.H2SO4濃度為2.5mol·L-1
B.OA段產生的是NO,AB段的反應為Fe+2Fe3+=3Fe2+,BC段產生氫氣
C.第二份溶液中最終溶質為FeSO4
D.原混合酸中NO3-的物質的量為0.1mol
科目:高中化學 來源:2017屆山東省日照市高三上學期期中化學試卷(解析版) 題型:填空題
工業合成氨:N2(g)+3H2(g) 2NH3(g) △H<0,氨又可以進一步制各硝酸,在工業上一般可進行連續生產。請回答下列問題:
2NH3(g) △H<0,氨又可以進一步制各硝酸,在工業上一般可進行連續生產。請回答下列問題:
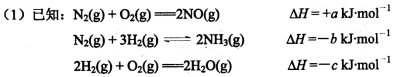
若有68g氨氣經催化氧化完全生成NO(g)和H2O(g)所放出的熱量為___________KJ。
(2)合成氨反應達到平衡后,某時刻改變下列選項中的__________條件,在達到新平衡的過程中逆反應速率始終增大。
a.升溫 b.縮小容積 c.增大c(N2) d .使用催化劑
.使用催化劑
(3)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對合成氨反應的影響。實驗結果如下圖所示:(圖中T表示溫度,橫軸表示起始時H2的物質的量,縱軸表示平衡時NH3的體積分數)
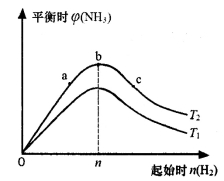
圖像中T1和T2的關系是:T1____________T2 (填“>”“<”或“=”)。
比較在a、b、c三點所處的平衡狀態中,反應物N 2的轉化率最大的是_______________(填字母)。
2的轉化率最大的是_______________(填字母)。
③若容器容積為1L,b點對應的起始時n(H2)=0.30mol,測得平衡時H2的轉化率為60%,則平衡時c(N2)為_________________mo1·L-1。(已知反應物的物質的量按n(H2):n(N2)=3:1投料時,平衡時NH3的體積分數最大)
(4)一定溫度下,將2mol N2和4mol H2置于1L的恒容密閉容器中反應,測得不同溫度(T)、不同時間段內工業合成氨反應中N2的轉化率,得到數據如下表所示:
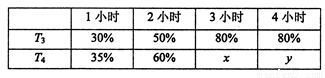
上表中x、y的大小關系為x_____________y。(填“>”“=”“<”“≥”或“≤” )
)
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第三次周考化學卷(解析版) 題型:選擇題
我國古代科技發達,下列有關古代文獻的說法錯誤的是
A.明朝的《本草綱目》記載“燒酒非古法也,自元時創始,其法用濃酒和糟入甑(指蒸鍋),蒸令氣上,用器承滴露。”該段文字記載了白酒(燒酒)的制造過程中采用了蒸餾的方法來分離和提純。
B.漢朝的《淮南萬畢術》、《神農本草經》記載“白青(堿式碳酸銅)得鐵化為銅”,“石膽……能化鐵為銅”都是指銅可以采用濕法冶煉。
C.清初《泉州府志》物產條載: “初,人不知蓋泥法,元時南安有黃長者為宅煮糖,宅垣忽壞,去土而糖白,后人遂效之 。”該段文字記載了蔗糖的分離提純采用了黃泥來吸附紅糖中的色素。
。”該段文字記載了蔗糖的分離提純采用了黃泥來吸附紅糖中的色素。
D.晉代葛洪的《抱樸子》記載“丹砂燒之成水銀,積變又成丹砂”,是指加熱時丹砂(HgS)熔融成液態,冷卻時重新結晶為HgS晶體。
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省高三上模擬四化學卷(解析版) 題型:選擇題
下列實驗中,對應的現象以及結論都正確且兩者具有因果關系的是( )
選項 | 實驗 | 現象 | 結論 |
A. | 將稀硝酸加入過量鐵粉中,充分反應后滴加KSCN溶液 | 有氣體生成,溶液呈血紅色 | 稀硝酸將Fe氧化為Fe3+ |
B. | 向飽和Na2CO3溶液中通CO2 | 有晶體析出 | 溶解度: NaHCO3< Na2CO3 |
C. | 用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱 | 熔化后的液態鋁滴落下來 | 金屬鋁的熔點較低 |
D. | 將10mL 0.1mol·L-1NaOH溶液滴入1 mL 0.1mol·L-1MgSO4溶液中,再滴加0.1mol·L-1 CuSO4溶液 | 先有白色沉淀生成后變為淺藍色沉淀 | Cu(OH)2的溶度積比Mg(OH)2的小 |
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:填空題
研究大氣中含硫化合物(主要是SO2和H2S)的轉化具有重要意義。
(1)高濕條件下,寫出大氣中SO2轉化為HSO3-的方程式:__________;____________。
(2)土壤中的微生物可將大氣中H2S經兩步反應氧化成SO42-,兩步反應的能量變化示意圖如下:
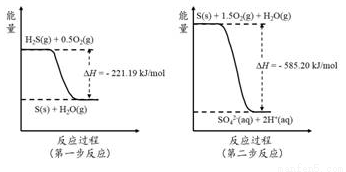
1mol H2S(g)全部氧化成SO42-(aq)的熱化學方程式為_________________________。
(3)二氧化硫—空氣質子交換膜燃料電池可以利用大氣所含SO2快速啟動,其裝置示意圖如下:
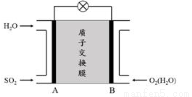
①質子的流動方向為_________________(“從A到B”或“從B到A”)。
②負極的電極反應式為__________________________。
(4)燃煤煙氣的脫硫減排是減少大氣中含硫化合物污染的關鍵。SO2煙氣脫除的一種工業流程如下:
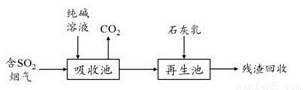
① 用純堿溶液吸收SO2將其轉化為HSO3-,反應的離子方程式是________________。
② 若石灰乳過量,將其產物再排回吸收池,其中可用于吸收SO2的物質的化學式是_____________。
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:選擇題
普伐他汀是—種調節血脂的藥物,其結構簡式如圖所示(未表示出其空間構型)。下列關 于普伐他汀的描述不正確的是
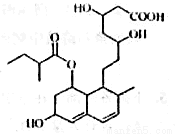
A.能使酸性KMnO4溶液褪色
B.能發生加成、取代、消去反應
C.其分子式為C23H35O7
D.1mol該物質最多可與2molNaOH反應
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:選擇題
將過量的SO2通入下列溶液中,最終溶液變渾濁或有沉淀生成的是
①Ca(OH)2②BaCl2③Na2SiO3④Ba(NO3)2⑤苯酚鈉⑥Na2CO3
A.①②③⑥ B.②⑤⑥ C.③④⑤⑥ D.③④⑤
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:選擇題
氨催化氧化法制硝酸的原理為4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在濃氨水中通入空氣,將赤熱鉑絲插入氨水中引發反應后鉑絲保持紅熱狀態至反應停止。下列說法正確的是
4NO(g)+6H2O(g)。在濃氨水中通入空氣,將赤熱鉑絲插入氨水中引發反應后鉑絲保持紅熱狀態至反應停止。下列說法正確的是
A.上述反應在較高溫度下才能自發進行
B.該反應的正反應活化能小于逆反應活化能
C.該反應中,斷裂化學鍵的總鍵能大于形成化學鍵的總鍵能
D.若NH3和O2的混合氣發生上述反應,氣體通入足量水中,剩余氣體一定是O2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年青海省高二11月月考化學試卷(解析版) 題型:選擇題
以下是表示反應2A+B=3C+4D的反應速率數據。按照反應快慢順序排列應為( )[
①υ(A)=0.5mol·L-1·S-1 ②υ(B)=0.3mol·L-1·S-1
③υ(C )=0.8mol·L-1·S-1 ④υ(
)=0.8mol·L-1·S-1 ④υ( D)=1mol·L-1·S-1
D)=1mol·L-1·S-1
A.④>③>①>② B.②>③>①=④ C.②>③>①>④ D.③>②>①=④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com