
【題目】為了防止槍支生銹,常將槍支的鋼鐵零件放在NaNO2和NaOH的混合溶液中進行化學處理使鋼鐵零件表面生成Fe3O4的致密的保護層——“發藍”。其過程可用下列化學方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O→
H2O→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2=Fe3O4+4NaOH
請回答下列問題:
(1)配平化學方程式②,各物質前的化學計量數依次為______。
(2)上述反應①中還原劑為______,被還原的是______。若有1 mol Na2FeO2生成,則反應①中有________mol電子發生轉移。
(3)關于“發藍”的過程,下列說法正確的是________(填字母)。
A.該過程不會產生污染
B.反應③生成的四氧化三鐵具有抗腐蝕作用
C.反應①②③均是氧化還原反應
D.反應①②中的氧化劑均為NaNO2
(4)當混合溶液中NaOH濃度過大,“發藍”的厚度會變小,其原因是_________________。
【答案】(1)6 1 5 3 1 7
(2)Fe NaNO2 2
(3)BD
(4)反應③為可逆反應,氫氧化鈉濃度過大,平衡向逆反應方向移動
【解析】(1)根據氧化還原反應中得失電子總數相等配平該化學方程式,各物質前的化學計量數依次是6,1,5,3,1,7。(2)反應①中還原劑是Fe,被還原的是NaNO2,若有1 mol Na2FeO2生成,則反應①中有2 mol電子發生轉移。(3)反應過程中有氨氣生成,所以產生污染,故A項錯誤;“發藍”過程中形成致密的保護層,所以反應③生成的Fe3O4具有抗腐蝕性,B項正確;③不是氧化還原反應,C項錯誤;反應①②中的氧化劑均為NaNO2,D項正確。(4)反應③為可逆反應,混合溶液中氫氧化鈉濃度過大時,平衡向逆反應方向移動。


科目:高中化學 來源: 題型:
【題目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之間的關系如圖所示。則下列說法正確的( )
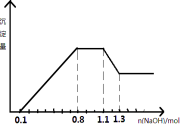
A.溶液中的陽離子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+)∶c(Al3+)∶c(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中錯誤的是
A.分液時,分液漏斗下層液體從下口放出,上層液體從上口倒出
B.蒸餾時,應使溫度計水銀球靠近蒸餾燒瓶支管口
C.蒸發結晶時應將溶液蒸干
D.稱量時,稱量物放在稱量紙上,置于托盤天平的左盤,砝碼放在托盤天平的右盤中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列變化中,按氮元素被還原、被氧化、既被氧化又被還原、既不被氧化又不被還原的順序排列正確的是( )
①大氣通過閃電固氮 ②硝酸分解 ③實驗室用氯化銨和消石灰制取氨氣 ④二氧化氮溶于水中
A. ①②③④ B. ②④①③
C. ①③④② D. ②①④③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業在現代農業、國防工業中,有著重要的地位。已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1。
2NH3(g)ΔH=-92kJ·mol-1。
(1)下列有關該反應速率的敘述,正確的是 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,但可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)該反應的化學平衡常數表達式為K=_________________。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得混合氣體中氨的體積分數為20%,則該溫度下反應的K= (用分數表示)。
(4)對于合成氨反應而言,下列有關圖像一定正確的是_____________。
a. b.
b. c.
c.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在一個容積為1 L的密閉容器中,充入1 mol H2(g)和1 mol I2(g),發生反應H2(g) + I2(g) ![]() 2 HI(g),經充分反應達到平衡后,HI(g)的氣體體積分數為50%,在該溫度下,在另一個容積為2L的密閉容器中充入1 mol HI(g)發生反應HI(g)
2 HI(g),經充分反應達到平衡后,HI(g)的氣體體積分數為50%,在該溫度下,在另一個容積為2L的密閉容器中充入1 mol HI(g)發生反應HI(g) ![]()
![]() H2(g) +
H2(g) + ![]() I2(g),則下列判斷正確的是( )
I2(g),則下列判斷正確的是( )
A.第二個反應的平衡常數為1
B.第二個反應的平衡常數為0.05
C.第二個反應達到平衡時,H2的平衡濃度為0.25 mol/L
D.第二個反應達到平衡時,HI(g)的平衡濃度為0.25 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在水溶液中,橙紅色的Cr2O72-與黃色的CrO42-有下列平衡關系:
Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
把重鉻酸鉀(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈_______色,因為 。
(2)向已加入NaOH溶液的(1)溶液中再加入過量稀H2SO4,則溶液呈________色,因為________________。
(3)向原溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4為黃色沉淀),則平衡________,溶液顏色將 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com