
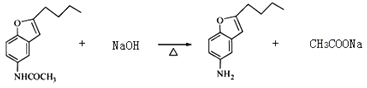
【題目】化合物H是合成抗心律失常藥物泰達隆的一種中間體,可通過以下方法合成:
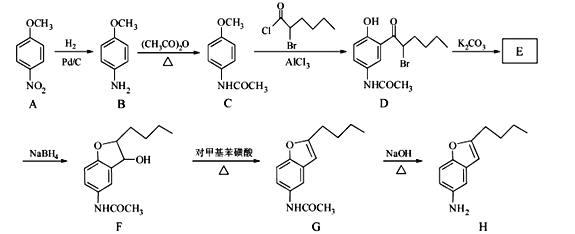
(1)D中的含氧官能團名稱為_____________(寫兩種)。
(2)F→G的反應類型為_____________________。
(3)寫出同時滿足下列條件的C的一種同分異構體的結構簡式_________________。
①能發生銀鏡反應;②能發生水解反應,其水解產物之一能與FeCl3溶液發生顯色反應;
③分子中只有4種不同化學環境的氫。
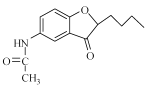
(4)E經還原得到F,E的分子式為C14H17O3N,寫出E的結構簡式_____________。
(5)G→H的反應方程式為______________________________________。
【答案】酚羥基、羰基、酰胺鍵 消去反應 ![]() 或
或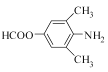 或
或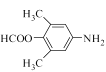
【解析】
物質A中硝基被還原為氨基,得到物質B,物質B和乙酸酐反應,將氨基變成了酰胺鍵,得到物質C;物質C中甲氧基的鄰位氫被取代,生成物質D;物質E在NaBH4作用下發生還原反應,生成F,應是結構中羰基被還原,所以對比D和F的結構可知E的結構簡式為: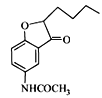 ;物質F發生消去反應,產生物質G,物質G中酰胺鍵經堿性條件下水解得到物質H。
;物質F發生消去反應,產生物質G,物質G中酰胺鍵經堿性條件下水解得到物質H。
(1).D中含氧官能團為:酚羥基、羰基、酰胺鍵,注意苯環通常不看作官能團,溴原子不是含氧官能團;
(2). 物質F變為物質G,失去了一分子水,產生了一個碳碳雙鍵,所以發生的是消去反應;
(3).物質C的結構為: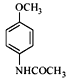 ,除苯環外,只有一個不飽和度。能發生銀鏡反應,說明結構中有醛基,能發生水解反應,且水解產物之一能與FeCl3發生顯色反應,說明結構中含甲酸酚酯基。除苯環、甲酸酚酯基外,還剩下2個碳和一個N,考慮對稱性,2個碳應作為2個甲基來看,考慮對稱性來滿足有4種不同化環境的 氫,可得出滿足條件的C的同分異構體可以是:
,除苯環外,只有一個不飽和度。能發生銀鏡反應,說明結構中有醛基,能發生水解反應,且水解產物之一能與FeCl3發生顯色反應,說明結構中含甲酸酚酯基。除苯環、甲酸酚酯基外,還剩下2個碳和一個N,考慮對稱性,2個碳應作為2個甲基來看,考慮對稱性來滿足有4種不同化環境的 氫,可得出滿足條件的C的同分異構體可以是: ![]() 或
或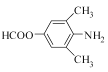 或
或 ;
;
(4).除上述分析中通過比對F和D結構,反推出E的結構外,也可經分析可知,物質D變成E,就是溴原子和羥基H去掉,碳與氧對接成環: 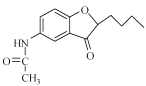 ;
;
(5).物質G變成物質H,就是酰胺鍵的堿性水解: 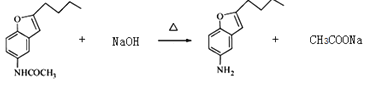 ,注意生成乙酸鈉及加熱條件的標注。
,注意生成乙酸鈉及加熱條件的標注。


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】下列各組物質之間的化學反應,反應產物一定為純凈物的是( )
A. 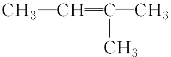 ―→
―→
B. CH2===CH—CH2—CH3+HCl![]()
C. CH3—CH===CH2+H2O![]()
D. nCH2===CH2+nCH2===CH—CH3![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關離子方程式正確的是( )
A.稀硝酸和過量的鐵屑反應:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入過量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氫鈉溶液水解的離子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氫碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的短周期主族元素。通常狀況下,X與W元素均能形成-1價的氣態氫化物,Y為同周期主族元素中原子半徑最大的元素,X、Z和W的原子最外層電子數之和為20。回答下列問題:
(1) W在元素周期表中的位置是__________。
(2)X和Y元素簡單離子的半徑較大的是________(填離子符號);Z和W元素氣態氫化物的穩定性較弱的是__________(填化學式)。
(3)Y的氧化物中既含離子鍵又含共價鍵的是__________(用電子式表示)。
(4)Z的最高價氧化物對應水化物的濃溶液(過量)和氧化亞銅共熱,反應的化學方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一氯化硫(S2Cl2)是一種重要的有機合成氯化劑,實驗室和工業上都可以用純凈干燥的氯氣與二硫化碳反應來制取(CS2+3Cl2![]() CCl4+S2Cl2),其裝置如下:
CCl4+S2Cl2),其裝置如下:
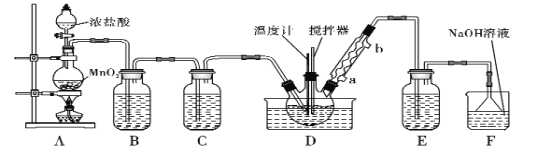
(1)A裝置中的離子反應方程式為______________。
(2) 一氯化硫(S2Cl2)常溫下較為穩定,受熱易分解,易被氧化,且遇水即歧化,歧化產物中不僅有淡黃色固體,而且還有兩種氣體,用NaOH溶液吸收該氣體可得兩種鹽Na2SO3和NaCl。 寫出一氯化硫與水反應的化學反應方程式______________。
(3)B裝置的作用是___________________________________。
(4)D中冷凝管的冷水進水口為____(填“a”或“b”);實驗過程中,需要先點燃A處酒精燈,通入氯氣一段時間后方可向D中水槽里面加入熱水加熱,這樣做的目的是______________。
(5)F裝置是用來處理尾氣氯氣的,已知該吸收反應的氧化產物不僅有NaClO還有NaClO3,且n(NaClO)/n(NaClO3)=3/1,則該反應被還原的氯原子與被氧化的氯原子物質的量之比為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率和限度與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,在 400mL 稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
時間/min | 1 | 2 | 3 | 4 | 5 |
氫氣體積/mL (標準狀況) | 100 | 240 | 464 | 576 | 620 |
①哪一時間段反應速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 時間段以鹽酸的濃度變化來表示的該反應速率______(設溶液體積不變)。
(2)另一學生為控制反應速率防止反應過快難以測量氫氣體積,他事先在鹽酸中加入等體積的下列溶液以減慢反應速率,你認為不可行的是______ (填字母)。
A.蒸餾水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某溫度下在 4 L 密閉容器中,X、Y、Z 三種氣態物質的物質的量隨時間變化曲線如圖:
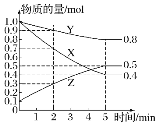
①該反應的化學方程式是______。
②該反應達到平衡狀態的標志是_______(填字母)。
A.Y 的體積分數在混合氣體中保持不變
B.X、Y 的反應速率比為 3:1
C.容器內氣體壓強保持不變
D.容器內氣體的總質量保持不變
E.生成 1mol Y 的同時消耗 2mol Z
③2 min 內 Y 的轉化率為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某溫度時,在2 L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示。
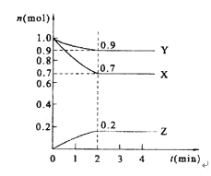
(1)反應物為____________生成物為_____________;
(2)由圖中所給數據進行分析,該反應的化學方程式為__________________________;
(3)反應從開始至2分鐘末,用Z的濃度變化表示的平均反應速率為v(Z)=_________;
(4)當反應進行了3 min,該反應是否達到平衡___________(填“是”或“否”)。
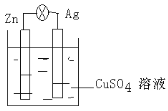
Ⅱ.在銀鋅原電池中,以硫酸銅為電解質溶液,鋅為___________極,電極上發生的是___________反應(“氧化”或“還原”)。銀為___________極,電極反應式是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用惰性電極電解下列溶液一段時間后再加入一定量的某種純凈物(方括號內物質),能使溶液恢復到原來的成分和濃度的是 ( )
A. AgNO3[AgNO3] B. NaOH [NaOH]
C. KCl [KCl] D. CuSO4 [CuCO3]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環己烯常用于有機合成。現通過下列流程,以環己烯為原料合成環醚、聚酯、橡膠,其中F可以作內燃機的抗凍劑,J分子中無飽和碳原子。
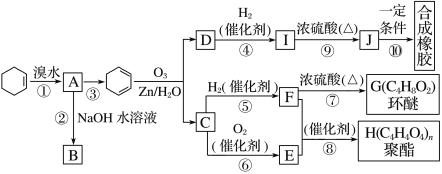
已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反應條件是_________________________________________________。
(2)A的名稱是_______________________________________________。
(3)有機物B和I的關系為________(填字母)。
A.同系物 B.同分異構體
C.都屬于醇類 D.都屬于烴
(4)①~⑩中屬于取代反應的________________________________________。
(5)寫出反應⑩的化學方程式____________________________________。
(6)寫出兩種D的屬于酯類的鏈狀同分異構體的結構簡式:_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com