
【題目】(17分)下表是元素周期表的一部分, 針對表中的①~⑨種元素,填寫下列空白(填寫序號不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在這些元素中,化學性質最不活潑的是:_____。(填元素符號)
(2)在最高價氧化物的水化物中,酸性最強的化合物的化學式是/span>______,堿性最強的化合物的化學式是:__________。
(3)比較①與⑤的最高價氧化物對應的水化物,_________的酸性強(填化學式);能通過________________________________說明(寫反應的化學方程式)。
(4)實驗室制取②的氫化物的化學方程式_______________________________ ,②的氫化物與②的最高價氧化物的水化物反應所得的產物化學式為______
(5)②可以形成多種氧化物,其中一種是紅棕色氣體,試用方程式說明該氣體不宜采用排水法收集的原因________________(用化學方程式表示)
(6)比較③與⑥的氫化物,_________ 更穩定(填化學式)
(7)寫出④的單質與水反應的離子方程式_______________________。
(8)寫出⑦元素的離子結構示意圖______,該離子半徑_________ S2-(填“﹥”或“﹤”)寫出⑩元素在周期表的位置_______________________
【答案】 Ar HClO4 KOH H2CO3 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ Ca(OH)2 +2NH4Cl ![]() CaCl2+2NH3↑+2H2O NH4NO3 3NO2+H2O=2HNO3+NO H2O 【答題空10】2Na+2H2O==2Na++2OH-+H2↑
CaCl2+2NH3↑+2H2O NH4NO3 3NO2+H2O=2HNO3+NO H2O 【答題空10】2Na+2H2O==2Na++2OH-+H2↑ ![]() < 第四周期第ⅦA族
< 第四周期第ⅦA族
【解析】由元素在周期表中的位置可知,①為C、②為N、③為O、④為Na、⑤為Si、⑥為S、⑦為Cl、⑧為Ar、⑨為K、⑩為Br。
(1)稀有氣體Ar最外層為8電子穩定結構,化學性質最不活潑,故填Ar;(2)上述元素中Cl的最高價含氧酸高氯酸酸性最強,高氯酸化學式為HClO4,K的金屬性最強,故KOH堿性最強;(3)同主族自上而下,非金屬性減弱,最高價氧化物對應水化物的酸性減弱,故酸性H2CO3>H2SiO3;可以利用強酸制備弱酸原理進行驗證,方程式為:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;(4)實驗室用氯化銨與氫氧化鈣反應制備氨氣,反應生成氯化鈣、氨氣與水,反應方程式為: Ca(OH)2 +2NH4Cl ![]() CaCl2+2NH3↑+2H2O;②的氫化物與②的最高價氧化物的水化物反應所得的產物化學式為NH4NO3;(5)該紅棕色氣體為二氧化氮,二氧化氮與水反應生成硝酸與NO,反應方程式為:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集;(6)同主族自上而下非金屬性減弱,氣態氫化物穩定性減弱,故H2O更穩定比較③與⑥的氫化物,H2O比H2S更穩定;(7)鈉與水反應生成氫氧化鈉與氫氣,反應離子方程式為:2Na+2H2O=2Na++2OH-+H2↑;(8)氯離子核外有18個電子,有3個電子層,各層電子數為2、8、8,離子結構示意圖為
CaCl2+2NH3↑+2H2O;②的氫化物與②的最高價氧化物的水化物反應所得的產物化學式為NH4NO3;(5)該紅棕色氣體為二氧化氮,二氧化氮與水反應生成硝酸與NO,反應方程式為:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集;(6)同主族自上而下非金屬性減弱,氣態氫化物穩定性減弱,故H2O更穩定比較③與⑥的氫化物,H2O比H2S更穩定;(7)鈉與水反應生成氫氧化鈉與氫氣,反應離子方程式為:2Na+2H2O=2Na++2OH-+H2↑;(8)氯離子核外有18個電子,有3個電子層,各層電子數為2、8、8,離子結構示意圖為![]() ;電子層結構相同,核電荷數越大離子半徑越小,故離子半徑Cl-<S2-;溴處于第四周期ⅦA族。
;電子層結構相同,核電荷數越大離子半徑越小,故離子半徑Cl-<S2-;溴處于第四周期ⅦA族。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】臭氧是理想的煙氣脫硝劑,其脫硝反應為2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T溫度下,向2.0 L恒容密閉容器中充入2.0 mol NO2和1.0 mol O3,經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
N2O5(g)+O2(g),在T溫度下,向2.0 L恒容密閉容器中充入2.0 mol NO2和1.0 mol O3,經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有關說法正確的是
A.反應在0~3 s內的平均速率v(NO2)=0.24 mol·L1·s1
B.24 s后,若保持其他條件不變,降低溫度,達到新平衡時測得c(O2)=0.44 mol·L1,則反應的ΔH>0
C.在T溫度下,起始時向容器中充入2.0 mol N2O5和2.0 mol O2,達到平衡時,N2O5的轉化率大于20%
D.在T溫度下,起始時向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反應達到平衡時,壓強為起始時的0.88倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:
①將堿式滴定管用蒸餾水洗凈,再用待測溶液潤洗后,注入待測溶液,然后調節滴定管的尖嘴部分充滿溶液,并使液面處于"0"刻度以下的位置,記下讀數;
②將酸式滴定管用蒸餾水洗凈,再用標準酸液潤洗后,向其中注入0.1000mol/L標準鹽酸,調節滴定管的尖嘴部分充滿溶液,并使液面處于"0"刻度以下的位置,記下讀數;
③用蒸餾水將錐形瓶洗凈后,從堿式滴定管中放入20.00mL待測溶液,滴入甲基橙作指示劑,然后用標準鹽酸進行滴定。滴定至指示劑剛好變色,且半分鐘內顏色不再改變為止,測得所耗鹽酸的體積為V1mL;
④重復以上過程,測得所耗鹽酸的體積為V2mL。
試回答下列問題:
(1)錐形瓶中溶液的顏色從_________色變為___________色時,停止滴定。
(2)下圖中,第②步“調節滴定管的尖嘴部分充滿溶液”方法正確的是_________,如果滴定前有氣泡,滴定后氣泡消失,由此對測定結果形成的影響是___________(填“偏高”、“偏低”或“無影響”)
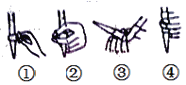
(3)圖中是某次滴定時的滴定管中的液面,其讀數為__________mL。
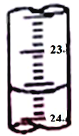
(4)根據下列數據:
滴定次數 | 待測液體積 | 標準鹽酸體積(mL) | |
滴定前讀數(mL) | 滴定后讀數(mL) | ||
第一次 | 20.00 | 0.20 | 24.10 |
第二次 | 20.00 | 3.00 | 27.10 |
請計算待測燒堿溶液的濃度為____________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸銅和堿式碳酸銅均可溶于鹽酸轉化為氯化銅。高溫下這兩種化合物均能分解成氧化銅。溶解28.4g上述混合物,消耗1mol/L鹽酸500mL.灼燒等質量的上述混合物,得到氧化銅的質量是
A. 35g B. 30g C. 20g D. 15g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(18分)2-氨基-3-氯苯甲酸(F)是重要的醫藥中間體,其制備流程圖如下:
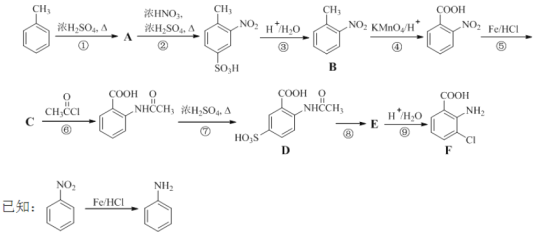
回答下列問題:
(1)![]() 分子中不同化學環境的氫原子共有_______種,共面原子數目最多為_______。
分子中不同化學環境的氫原子共有_______種,共面原子數目最多為_______。
(2)B的名稱為_________。寫出符合下列條件B的所有同分異構體的結構簡式_______。
a.苯環上只有兩個取代基且互為鄰位 b.既能發生銀鏡反應又能發生水解反應
(3)該流程未采用甲苯直接硝化的方法制備B,而是經由①②③三步反應制取B,其目的是______________。
(4)寫出⑥的化學反應方程式:_________,該步反應的主要目的是____________。
(5)寫出⑧的反應試劑和條件:_______________;F中含氧官能團的名稱為__________。
(6)在方框中寫出以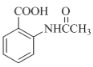 為主要原料,經最少步驟制備含肽鍵聚合物的流程。
為主要原料,經最少步驟制備含肽鍵聚合物的流程。
|
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各元素性質的遞變規律錯誤的是( )
A.Li、Be、B原子最外層電子數依次增多
B.P、S、Cl元素的最高正化合價依次升高
C.B、C、N、O、F原子半徑依次增大
D.Li、Na、K、Rb的金屬性依次增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化氫是重要的氧化劑、還原劑,它的水溶液又稱為雙氧水,常用作消毒、殺菌、漂白等。某化學興趣小組取一定量的過氧化氫溶液,準確測定了過氧化氫的含量。請填寫下列空白:
移取10.00 mL密度為ρ g/mL的過氧化氫原溶液稀釋成250 mL。量取稀過氧化氫溶液25.00 mL至錐形瓶中,加入稀硫酸酸化,用蒸餾水稀釋,作被測試樣。
(1)用高錳酸鉀法(一種氧化還原滴定法)可測定待測液中的H2O2的含量。若需配制濃度為0.10 mol·L1的KMnO4標準溶液500 mL,應準確稱取_________g KMnO4[已知M(KMnO4)=158.0 g·mol1]。
a.配制該標準溶液時,下列儀器中不必要用到的有_________。(用編號表示)。
①托盤天平 ②燒杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥膠頭滴管 ⑦移液管
b.定容時仰視讀數,導致最終結果__________(填“偏大”“偏小”或“不變”)。
(2)完成并配平離子方程式:
![]()
![]() +
+![]() H2O2+
H2O2+![]()
![]()
![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定時,將高錳酸鉀標準溶液注入____________(填“酸式”或“堿式”)滴定管中。滴定到達終點的現象是____________________________________________。
(4)重復滴定三次,平均耗用KMnO4標準溶液V mL,則原過氧化氫溶液中過氧化氫的質量分數為_____________。
(5)若滴定前滴定管尖嘴中有氣泡,滴定后氣泡消失,則測定結果______________ (填“偏高”或“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質](15分)
研究發現,在CO2低壓合成甲醇反應(CO2+3H2=CH3OH+H2O)中,Co氧化物負載的Mn氧化物納米粒子催化劑具有高活性,顯示出良好的應用前景。回答下列問題:
(1)Co基態原子核外電子排布式為_____________。元素Mn與O中,第一電離能較大的是_________,基態原子核外未成對電子數較多的是_________________。
(2)CO2和CH3OH分子中C原子的雜化形式分別為__________和__________。
(3)在CO2低壓合成甲醇反應所涉及的4種物質中,沸點從高到低的順序為_________,原因是______________________________。
(4)硝酸錳是制備上述反應催化劑的原料,Mn(NO3)2中的化學鍵除了σ鍵外,還存在________。
(5)MgO具有NaCl型結構(如圖),其中陰離子采用面心立方最密堆積方式,X射線衍射實驗測得MgO的晶胞參數為a=0.420nm,則r(O2-)為________nm。MnO也屬于NaCl型結構,晶胞參數為a' =0.448 nm,則r(Mn2+)為________nm。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[2016新課標Ⅰ]NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產工藝如下:

回答下列問題:
(1)NaClO2中Cl的化合價為_______。
(2)寫出“反應”步驟中生成ClO2的化學方程式_______。
(3)“電解”所用食鹽水由粗鹽水精制而成,精制時,為除去Mg2+和Ca2+,要加入的試劑分別為________、________。“電解”中陰極反應的主要產物是____________。
(4)“尾氣吸收”是吸收“電解”過程排出的少量ClO2。此吸收反應中,氧化劑與還原劑的物質的量之比為___________,該反應中氧化產物是____________。
(5)“有效氯含量”可用來衡量含氯消毒劑的消毒能力,其定義是:每克含氯消毒劑的氧化能力相當于多少克Cl2的氧化能力。NaClO2的有效氯含量為__________。(計算結果保留兩位小數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com