
分析 Ⅰ.(1)水電離產生的H+、OH-的濃度乘積即:c(H+)水•c(OH-)水=10-22,則c(H+)=10-11mol/L,根據Kw=10-12計算c(OH),然后計算氫氧化鈉的質量;
(2)若保持溫度不變,已知Kw=10-12,中性溶液中pH=6,某溶液中c(H+)為1×10-7mol/L<1×10-6mol/L,溶液顯堿性;
II.(3)n(NaOH)=1mol/L×0.6L=0.6mol,n(CO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
設生成的n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根據Na、C原子守恒得$\left\{\begin{array}{l}{2x+y=0.6}\\{x+y=0.4}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$,
所以溶液中溶質為等物質的量濃度的Na2CO3、NaHCO3,碳酸根離子水解程度大于碳酸氫根離子,二者水解導致溶液呈堿性;
(4)在FeCl3溶液中加入NaHCO3溶液,二者發生雙水解反應生成氫氧化鐵沉淀和二氧化碳;溶液的pH=4,則溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
(5)FeS(s)?Fe2+(aq)+S2-(aq),加入稀鹽酸后,S2-+2H+=H2S↑,促進FeS溶解.
解答 解:I.(1)水電離產生的H+、OH-的濃度乘積即:c(H+)水•c(OH-)水=10-22,則c(H+)=10-11mol/L,已知Kw=10-12,c(OH)=$\frac{1{0}^{-12}}{1{0}^{-11}}$=0.1mol/L,則氫氧化鈉的物質的量為0.1mol/L×1L=0.1mol,則質量為0.1mol×40g/mol=4g,
故答案為:4;
(2)若保持溫度不變,已知Kw=10-12,中性溶液中pH=6,某溶液中c(H+)為1×10-7mol/L<1×10-6mol/L,溶液顯堿性,故答案為:堿;
II.(3)n(NaOH)=1mol/L×0.6L=0.6mol,n(CO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
設生成的n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根據Na、C原子守恒得$\left\{\begin{array}{l}{2x+y=0.6}\\{x+y=0.4}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$,
所以溶液中溶質為等物質的量濃度的Na2CO3、NaHCO3,碳酸根離子水解程度大于碳酸氫根離子,但其水解程度都較小,二者水解導致溶液呈堿性,鈉離子不水解,所以溶液中離子濃度大小順序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)在FeCl3溶液中加入NaHCO3溶液,二者發生雙水解反應生成氫氧化鐵沉淀和二氧化碳,離子方程式為Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;溶液的pH=4,則溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1{0}^{-10})^{3}}$mol/L=4.0×10-8mol/L;
故答案為:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;4.0×10-8;
(5)FeS(s)?Fe2+(aq)+S2-(aq),加入稀鹽酸后,S2-+2H+=H2S↑,破壞了FeS的溶解平衡,使上述平衡向FeS溶解的方向移動,則FeS能溶于稀鹽酸,
故答案為:FeS(s)?Fe2+(aq)+S2-(aq),加入稀鹽酸后,S2-+2H+=H2S↑,破壞了FeS的溶解平衡,使上述平衡向FeS溶解的方向移動,故FeS溶解.
點評 本題考查較綜合,涉及難溶物的溶解平衡、離子濃度大小比較、鹽類水解等知識點,為高頻考點,側重考查學生分析、判斷及計算能力,注意(3)中溶質及其物質的量之間的關系,為易錯點.


 新課標同步訓練系列答案
新課標同步訓練系列答案 一線名師口算應用題天天練一本全系列答案
一線名師口算應用題天天練一本全系列答案科目:高中化學 來源: 題型:解答題
 硫在空氣中燃燒可以生成SO2,SO2在催化劑作用下可以被氧化為SO3,其熱化學方程式可表示為:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如圖是上述兩個反應過程與能量變化的關系圖,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)與96g O2(g)所具有的能量.
硫在空氣中燃燒可以生成SO2,SO2在催化劑作用下可以被氧化為SO3,其熱化學方程式可表示為:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如圖是上述兩個反應過程與能量變化的關系圖,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)與96g O2(g)所具有的能量.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 無機化合物可根據其組成和性質進行分類,
無機化合物可根據其組成和性質進行分類,| 物質類別 | 酸 | 堿 | 鹽 | 酸性 氧化物 | 堿性 氧化物 |
| 化學式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

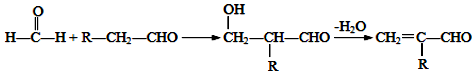
 .
.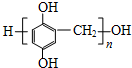 (寫出一種即可).
(寫出一種即可).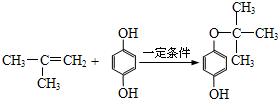 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它可能能使酸性高錳酸鉀溶液褪色 | |
| B. | 一氯代物可能只有一種 | |
| C. | 分子結構中甲基的數目可能是0、1、2 | |
| D. | 等質量CH4和C4H8分別在氧氣中完全燃燒,CH4的耗氧量小于C4H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3S+6NaOH═Na2SO3+2Na2S+3H2O | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | 2FeCl2+Cl2=3FeCl3 | |
| D. | 4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 溶液的pH=9時,溶液中存在下列關系:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒關系:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 由圖可知,往該溶液中逐滴滴加氫氧化鈉時NH4+和HCO3-濃度逐漸減小 | |
| D. | 通過分析可知常溫下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO的結構式:H-Cl-O | B. | 氨氣分子的比例模型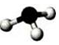 | ||
| C. | 原子核內有10個中子的氧原子:18O | D. | H2與H+互為同位素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com