
黃鐵礦(FeS2)燃燒產生的SO2通過下列工藝過程既能制得H2SO4,又能制得H2。
(1)該過程中能循環利用的物質為 。
(2)在該過程中,使用膜反應器及時分離出HI分解產生的H2,目的是 (用平衡移動的原理解釋)。
(3)某研究性學習小組欲探究SO2能否與BaCl2溶液反應生成BaSO3沉淀,進行如下實驗。已知濃硫酸的沸點為338℃,加熱時酒燈火焰的溫度為400℃~500℃。
①甲同學用裝置I進行實驗,發現BaCl2溶液中出現白色沉淀,且白色沉淀不溶于鹽酸,請解釋生成該白色沉淀的可能原因 (用離子方程式表示)。
②乙同學認為甲同學的裝置不完善,設計了改進裝置II進行實驗(夾持裝置和A中加熱裝置已略,氣密性已檢查)。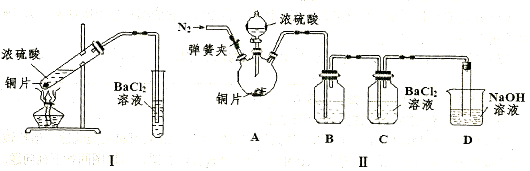
a.打開彈簧夾通入N2,一段時間后關閉彈簧夾;b.滴加一定量濃硫酸,加熱A,一段時間后C中未見沉淀生成。操作a的目的是 ,裝置B中的劑是 。
③丙同學取乙實驗后的C中溶液少許,滴加一種無色溶液,產生不溶于鹽酸的白色沉淀,丙同學滴加的試劑可能是 (填字母編號)。
a.NaOH溶液 b.H2O2溶液 c.新制氯水 d.酸性KmnO4溶液
④裝置D中與導管連接的是硬質玻璃管,則裝置D的作用是 。
(1)I2 (2分)
(2)使平衡向正反應方向移動,提高產物的產率。(2分)
(3)① SO42-+Ba2+=BaSO4↓或2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+(2分,答對一個即給分)
② 排出裝置中的O2(2分) 飽和NaHSO3溶液(2分)
③ b(2分) ④吸收尾氣并防倒吸(2分)
解析試題分析:(1)由工藝流程可知能循環利用的物質為I2。(2)及時分離出HI分解產生的H2,使HI的分解平衡向正反應方向移動,提高了I2和H2的產率。(3)本小題首先抓住已知信息“濃硫酸的沸點為338 ℃,加熱時酒精燈火焰的溫度為400℃~500℃”,說明濃硫酸在溫度較高時也能揮發出H2SO4蒸氣。①白色沉淀應為BaSO4,可能原因有二:一是揮發出的H2SO4提供的SO42-與Ba2+反應生成,二是空氣中O2的氧化所致。②操作a通入N2目的是排出裝置中的O2。C中未見沉淀生成,說明B中的試劑能吸收揮發出的H2SO4且不產生新的雜質,還不能與SO2反應,故該試劑應是飽和NaHSO3溶液。③乙實驗后的C中的溶液會溶有SO2,題中不溶于鹽酸的白色沉淀應是BaSO4,滴加一種無色溶液, 只能是H2O2溶液。④裝置D的作用是既能吸收未反應的SO2防止大氣污染,又能防止NaOH溶液倒吸入裝置C中影響實驗結果。
考點:本題是以研究SO2的性質為載體的實驗題,涉及化學平衡的移動原理的考查。


 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:實驗題
(12分)天然水是人類飲用水的主要來源。從天然水獲得可以飲用的水一般須經過沉降懸浮物、殺菌消毒等步驟。
(1)沉降懸浮物要在水中加入絮凝劑,如將鋁鹽加入水中能達到凈水目的,
原因是 (用離子方程式表示)。
(2)氯氣可用于自來水殺菌消毒劑,結合離子方程式和文字理由 。
(3)新型水處理劑高鐵酸鉀 (K2FeO4)具有強的氧化作用和絮凝作用。工業上可通過以下流程制備高鐵酸鉀: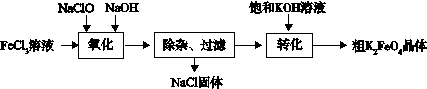
查閱資料:高鐵酸鹽在中性或酸性溶液中會逐漸分解,在堿性溶液中穩定。
完成“氧化”過程中的離子方程式
□Fe3+ + □ClO- +□ ="□" FeO42- + □Cl- + □
“轉化”過程中實現由Na2FeO4制得K2FeO4,是利用二者 性的不同。
③結合資料完成粗K2FeO4晶體的提純:將粗產品用 溶解,然后再加入飽和KOH溶液、冷卻結晶、過濾。
④高鐵酸鉀的應用還在不斷擴展中。如可制成高鐵電池, 電池反應為:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
放電時,正極反應為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
二氯化二硫(S2Cl2)在工業上用于橡膠的硫化。為在實驗室合成S2Cl2,某化學研究性學習小組查閱了有關資料,得到如下信息:
①將干燥的氯氣在110℃~140℃與硫反應,即可得S2Cl2粗品。
②有關物質的部分性質如下表:
| 物質 | 熔點/℃ | 沸點/℃ | 化學性質 | ||
| S | 112.8 | 444.6 | 略 | ||
| S2Cl2 | -77 | 137 |
|

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
選用適當裝置、試劑和方法可制備中學化學中的幾種常見氣體。請填寫表中的空格(從①~⑩中選擇,填序號):
| 實驗 | 氣體 | 所用裝置 | 氣體性質 | 干燥該氣體選用的試劑 |
| (1) | | ③ | 其水溶液顯堿性 | |
| (2) | | | 1mol最多能與2molH2反應 | ⑩ |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:
CO的制備原理:HCOOH CO↑+H2O,并設計出原料氣的制備裝置(如下圖)
CO↑+H2O,并設計出原料氣的制備裝置(如下圖)
請填寫下列空白:
(1)實驗室現有鋅粒、稀硝酸、稀鹽酸、濃硫酸、2-丙醇,從中選擇合適的試劑制備氫氣、丙烯。寫出制備丙烯的化學方程式: 。
(2)若用以上裝置制備干燥純凈的CO,裝置中a的作用是 ,裝置中b的作用是 ,c中盛裝的試劑是 。
(3)制丙烯時,還產生少量SO2、CO2及水蒸氣,該小組用以下試劑檢驗這四種氣體,混合氣體通過試劑的順序是 (填序號)
①飽和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④無水CuSO4;⑤品紅溶液
(4)正丁醛經催化加氫得到含少量正丁醛的1-丁醇粗品,為純化1-丁醇,該小組查閱文獻得知:①R—CHO+NaHSO3(飽和) RCH(OH)SO3Na↓;②沸點:乙醚34℃,
RCH(OH)SO3Na↓;②沸點:乙醚34℃,
1-丁醇118℃,并設計出如下提純路線:
試劑1為 ,操作2為 ,操作3為 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知用P2O5作催化劑,加熱乙醇可制備乙烯,反應溫度為80℃~210℃。某研究性小組設計了如下的裝置制備并檢驗產生的乙烯氣體(夾持和加熱儀器略去)。

(1)儀器a的名稱為_________________
(2)用化學反應方程式表示上述制備乙烯的原理______________________________。
(3)已知P2O5是一種酸性干燥劑,吸水放大量熱,在實驗過程中P2O5與乙醇能發生作用,因反應用量的不同,會生成不同的磷酸酯,它們均為易溶于水的物質,沸點較低。寫出乙醇和磷酸反應生成磷酸二乙酯的化學方程式(磷酸用結構式表示為 )__________________________________。
)__________________________________。
(4)某同學認為用上述裝置驗證產生了乙烯不夠嚴密,理由是___________________。
(5)某同學查文獻得知:40%的乙烯利(分子式為C2H6ClO3P)溶液和NaOH固體混和可快速產生水果催熟用的乙烯,請在上述虛線框內畫出用乙烯利溶液和NaOH固體制取乙烯的裝置簡圖(夾持儀器略)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
不久前,一則“食用撒了魚浮靈的魚蝦可能致癌”的微博在網上熱傳。“魚浮靈”的化學成分實為過碳酸鈉,使用不當會讓魚損傷,過碳酸鈉本身無毒無害,對人體不會有危害。過碳酸鈉,俗稱固體雙氧水,化學式為2Na2CO3·3H2O2,是一種無機鹽,是白色顆粒狀粉末,可以分解為碳酸鈉和過氧化氫。某探究小組制備過碳酸鈉并測定樣品中H2O2的含量,其制備流程和裝置示意圖如下:
已知:50 °C時 2Na2CO3·3H2O2 (s) 開始分解
主反應 2Na2CO3 (aq) + 3H2O2 (aq) 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反應 2H2O2 = 2H2O + O2↑
滴定反應 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 = 3K2SO4 + 6MnSO4+10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
根據以上信息回答下列問題:
(1)推測圖中支管的作用可能是 。
(2)步驟①的關鍵是控制溫度,結合裝置圖歸納其措施有 、
和 。
(3)在濾液X中加入適量NaCl固體或無水乙醇均可析出過碳酸鈉,原因是 。
(4)步驟③中選用無水乙醇洗滌產品的目的是 。
(5)測定樣品中H2O2的質量分數的方法是:準確稱取0.2000g過碳酸鈉樣品于250 mL 錐形瓶中,加50 mL 蒸餾水溶解,再加50 mL 2.000 mol·L-1 H2SO4 (H2SO4過量),用0.002000mol·L-1 KMnO4標準溶液滴定至終點時消耗30.00 mL。
①滴定前,滴定管需用KMnO4標準溶液潤洗2~3次,潤洗的操作方法是:關閉酸式滴定管活塞,向滴定管中注入少量KMnO4標準 。
②上述樣品中H2O2的質量分數計算表達式為 (只列出算式,不作任何運算!H2O2的式量為34.00)。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列實驗操作不能達到預期實驗目的的是
| | 實驗目的 | 實驗操作 |
| A | 鑒別乙酸乙酯和乙酸 | 分別加入飽和Na2CO3溶液 |
| B | 比較Fe和Cu的金屬活動性 | 分別加入濃硝酸 |
| C | 比較H2O和乙醇中羥基氫的活潑性 | 分別加入少量Na |
| D | 比較I2在H2O和CCl4中的溶解度 | 向I2水中加入CCl4,振蕩 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com