
【題目】某同學在實驗室進行以下實驗,請將實驗①②③的現象和離子反應方程式填入實驗報告中. 
編號 | 現象 | 離子方程式 |
① | ||
② | ||
③ |
【答案】有紅褐色沉淀生成;Fe3++3OH﹣═Fe(OH)3↓;有白色沉淀生成,溶液為藍色;Ba2++SO42﹣═BaSO4↓;有白色沉淀生成,滴加稀硝酸,沉淀不溶解;Ag++Cl﹣═AgCl↓
【解析】解:①中NaOH與硫酸鐵反應生成氫氧化鐵和硫酸鈉,觀察到有紅褐色沉淀生成,發生的離子反應為Fe3++3OH﹣═Fe(OH)3↓;②中氯化鋇與硫酸銅反應生成硫酸鋇和氯化銅,觀察到有白色沉淀生成,溶液為藍色,發生的離子反應為Ba2++SO42﹣═BaSO4↓;③中硝酸銀與氯化鋇反應生成AgCl和硝酸鋇,觀察到有白色沉淀生成,滴加稀硝酸,沉淀不溶解,發生的離子反應為Ag++Cl﹣═AgCl↓,所以答案是:
編號 | 現象 | 離子方程式 |
① | 有紅褐色沉淀生成 | Fe3++3OH﹣═Fe(OH)3↓ |
② | 有白色沉淀生成,溶液為藍色 | Ba2++SO42﹣═BaSO4↓ |
③ | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | Ag++Cl﹣═AgCl↓ |


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】某同學將一塊鋁箔用砂紙仔細打磨,除去表面的保護膜,用坩堝鉗夾住放在酒精燈火焰上加熱至熔化,發現熔化的鋁并不滴落,而是好像有一層膜兜著。對該現象的說法錯誤的是
A. 兜著液體的這層膜是氧化鋁
B. 該實驗說明了氧化鋁的熔點高于鋁的熔點
C. 鋁極易與空氣中的氧氣反應在表面形成氧化物保護膜
D. 鋁的化學性質較穩定,即使加熱到熔化也不與空氣中的氧氣反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.若原子X的質子數為a,則X的質量數一定不為a
B.若兩種元素形成的離子M2﹣和N+電子層結構相同,則離子半徑M2﹣>N+
C.同周期非金屬氧化物對應水化物酸性從左到右依次增強
D.由兩種元素組成的化合物,若含有離子鍵,就沒有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氣與氫氣反應生成氨氣的平衡常數見下表:
N2+3H22NH3 | ||||
溫度 | 25℃ | 200℃ | 400℃ | 600℃ |
平衡常數K | 5×108 | 650 | 0.507 | 0.01 |
(1)工業上合成氨的溫度一般控制在500℃,原因是 .
(2)在2L密閉容器中加入1mol氮氣和3mol氫氣,進行工業合成氨的模擬實驗,若2分鐘后,容器內壓強為原來的0.8倍,則0到2分鐘,氨氣的反應速率為mol/(Lmin).
(3)下列說法能表明該反應達到平衡的是 A.氣體的平均分子量不再變化 B.密閉容器內的壓強不再變化
C.v (N2)=2v (NH3) D.氣體的密度不再變化
(4)下列措施,既能加快該反應的反應速率,又能增大轉化率的是
A.使用催化劑
B.縮小容器體積
C.提高反應溫度
D.移走NH3
(5)常溫下,在氨水中加入一定量的氯化銨晶體,下列說法錯誤的是 . A.溶液的pH增大 B.氨水的電離度減小 C.c(OH﹣)減小 D.c(NH4+)減小
(6)將氨水與鹽酸等濃度等體積混合,下列做法能使c(NH4+)與c(Cl﹣)比值變大的是 A. 加入固體氯化銨 B.通入少量氯化氫
C. 降低溶液溫度 D.加入少量固體氫氧化鈉.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4超干重整CO2技術可得到富含CO的氣體,用于生產多種化工產品。該技術中的化學反應為:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下圖表示初始投料比n(CH4):n(CO2)為1:3或1:4,CH4的轉化率在不同溫度(T1、T2)下與壓強的關系。[注:投料比用a1、a2表示]

①a2=__________。
②判斷T1的T2的大小關系,并說明理由:__________。
(2)CH4超干重整CO2的催化轉化原理示意圖如下:

①過程Ⅰ,生成1mol H2時吸收123.5kJ熱量,其熱化學方程式是__________。
②過程Ⅱ,實現了含氫物種與含碳物種的分離。生成H2O(g)的化學方程式是__________。
③假設過程Ⅰ和過程Ⅱ中的各步均轉化完全,下列說法正確的是__________。(填序號)
a.過程Ⅰ和過程Ⅱ中發生了氧化還原反應
b.過程Ⅱ中使用的催化劑為Fe3O4和CaCO3
c.若過程Ⅰ投料![]() ,可導致過程Ⅱ中催化劑失效
,可導致過程Ⅱ中催化劑失效
【答案】 1:4 T2>T1 正反應為吸熱反應,溫度升高時甲烷的轉化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同條件下,投料比越小,甲烷的轉化率越大,據圖可知,a2>a1,故a2表示的是1:4時甲烷的轉化率,故答案為:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反應為吸熱反應,溫度升高時,平衡正向移動,甲烷的轉化率增大,則T2>T1,故答案為:T2>T1,正反應為吸熱反應,溫度升高時甲烷的轉化率增大;
2H2O(g)+4CO(g)的正反應為吸熱反應,溫度升高時,平衡正向移動,甲烷的轉化率增大,則T2>T1,故答案為:T2>T1,正反應為吸熱反應,溫度升高時甲烷的轉化率增大;
(2). ①.在過程I中,生成1mol H2時吸收123.5kJ熱量,據圖可知,其熱化學方程式為:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案為:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由過程II的轉化關系來看,混合氣體中的H2將Fe3O4還原為Fe,反應方程式為:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案為:4H2+Fe3O4
3Fe+4H2O,故答案為:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 兩個過程都有元素化合價的改變,都發生了氧化還原反應,故a正確;b. 過程II中Fe3O4最終被還原為Fe,Fe3O4不是催化劑,故b錯誤;c. 若初始投料比![]() 時,二者恰好按照題給方程式反應,無CO2生成,導致CaCO3無法參加反應,使催化劑中毒失效,故c正確;答案選ac。
時,二者恰好按照題給方程式反應,無CO2生成,導致CaCO3無法參加反應,使催化劑中毒失效,故c正確;答案選ac。
【題型】綜合題
【結束】
17
【題目】工、農業廢水以及生活污水中濃度較高的![]() 會造成氮污染。工業上處理水體中
會造成氮污染。工業上處理水體中![]() 的一種方法是零價鐵化學還原法。某化學小組用廢鐵屑和硝酸鹽溶液模擬此過程,實驗如下。
的一種方法是零價鐵化學還原法。某化學小組用廢鐵屑和硝酸鹽溶液模擬此過程,實驗如下。
(1)先用稀硫酸洗去廢鐵屑表面的鐵銹,然后用蒸餾水將鐵屑洗凈。
①除銹反應的離子反程式是__________。
②判斷鐵屑洗凈的方法是__________。
(2)將KNO3溶液的pH調至2.5。從氧化還原的角度分析調低溶液pH的原因是__________。
(3)將上述處理過的足量鐵屑投入(2)的溶液中。如圖表示該反應過程中,體系內相關離子濃度、pH隨時間變化的關系。請根據圖中信息回答:

①t1時刻前該反應的離子方程式是__________。
②t2時刻后,該反應仍在進行,溶液中![]() 的濃度在增大,Fe2+的濃度卻沒有增大,可能的原因是__________。
的濃度在增大,Fe2+的濃度卻沒有增大,可能的原因是__________。
(4)鐵屑與KNO3溶液反應過程中向溶液中加入炭粉,可以增大該反應的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有K2Cr2O7的廢水具有較強的毒性,工業上常用鋇鹽沉淀法處理含有K2Cr2O7的廢水并回收重鉻酸,具體的流程如下:

已知:CaCr2O7、BaCr2O7易溶于水,其它幾種鹽在常溫下的溶度積常數如下表所示。
物質 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度積 | 9.1×10-6 | 2.30×10-2 | 1.17×10-10 | 1.08×10-10 |
(1)用離子方程式表示K2Cr2O7溶液中同時存在K2CrO4的原因(將離子方程式補充完整):
![]() +__________=
+__________=![]() +__________。____________
+__________。____________
(2)向濾液1中加入BaCl2·2H2O的目的,是使![]() 從溶液中沉淀出來。
從溶液中沉淀出來。
①結合上述流程說明熟石灰的作用:__________。
②結合表中數據,說明選用Ba2+而不選用Ca2+處理廢水的理由:__________。
③研究溫度對![]() 沉淀效率的影響。實驗結果如下:在相同的時間間隔內,不同溫度下
沉淀效率的影響。實驗結果如下:在相同的時間間隔內,不同溫度下![]() 的沉淀率
的沉淀率 ,如下圖所示。
,如下圖所示。

已知:BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() ΔH>0
ΔH>0
![]() 的沉淀效率隨溫度變化的原因是__________。
的沉淀效率隨溫度變化的原因是__________。
(3)向固體2中加入硫酸,回收重鉻酸。
①硫酸濃度對重鉻酸的回收率如下圖所示。結合化學平衡移動原理,解釋使用0.450mol/L的硫酸時,重鉻酸的回收率明顯高于使用0.225mol/L的硫酸的原因:__________。

②回收重鉻酸的原理如圖所示。當硫酸濃度高于0.450mol/L時,重鉻酸的回收率沒有明顯變化,其原因是__________。

(4)綜上所述,沉淀BaCrO4并進一步回收重鉻酸的效果與__________有關。
【答案】 1 H2O 2 2 H+ 沉淀![]() ;調節溶液pH,使
;調節溶液pH,使![]() 轉化為
轉化為![]() 而沉淀 BaCrO4比CaCrO4更難溶,可以使
而沉淀 BaCrO4比CaCrO4更難溶,可以使![]() 沉淀更完全 溫度升高,沉淀速率加快 c(H2SO4)增大,則c(
沉淀更完全 溫度升高,沉淀速率加快 c(H2SO4)增大,則c(![]() )增大,與Ba2+生成沉淀,促進BaCrO4(s)
)增大,與Ba2+生成沉淀,促進BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() (aq)ΔH>0平衡右移,c(
(aq)ΔH>0平衡右移,c(![]() )增大;同時,c(H+)也增大,共同促進
)增大;同時,c(H+)也增大,共同促進![]() +H2O
+H2O![]()
![]() +2H+平衡左移,有利于生成更多的H2Cr2O7 BaSO4與BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其難于接觸H2SO4,阻礙重鉻酸生成 受到溶液pH、溫度、H2SO4濃度、BaCrO4顆粒大小等影響
+2H+平衡左移,有利于生成更多的H2Cr2O7 BaSO4與BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其難于接觸H2SO4,阻礙重鉻酸生成 受到溶液pH、溫度、H2SO4濃度、BaCrO4顆粒大小等影響
【解析】含有K2Cr2O7的廢水同時含有SO42,加入適量熟石灰過濾得到的固體1為硫酸鈣和濾液1,向濾液1中加入BaCl22H2O的目的是使CrO42從溶液中沉淀出來,過濾得到固體2為BaCrO4,濾液2檢測CrO42含量達標,向固體2中加入硫酸,回收重鉻酸,同時生成固體3為硫酸鋇沉淀。
(1). K2Cr2O7溶液中同時存在K2CrO4的原因是重鉻酸根離子在水溶液中存在化學平衡生成鉻酸根離子和氫離子,反應的離子方程式為Cr2O72+H2O2CrO42+2H+,故答案為:1、H2O、2、2、H+;
(2). ①. 根據表中物質的溶度積常數可知,熟石灰的作用是沉淀硫酸根離子,調節溶液pH使Cr2O72轉化為CrO42而沉淀,故答案為:沉淀SO42-,調節溶液pH,使Cr2O72轉化為CrO42而沉淀;
②. 根據表中數據可知,BaCrO4比CaCrO4更難溶,所以選用Ba2+處理廢水可以使CrO42沉淀更完全,故答案為:BaCrO4比CaCrO4更難溶,可以使CrO42沉淀更完全;
③. 根據圖象可知,CrO42的沉淀率隨溫度升高增大,沉淀速率加快,故答案為;溫度升高,沉淀速率加快;
(3). ①. c(H2SO4)增大,則c(SO42-)增大,與Ba2+生成沉淀,促使![]() Ba2+(aq)+CrO42(aq)平衡右移,使c(CrO42)增大,同時c(H+)也增大,共同促使Cr2O72+H2O
Ba2+(aq)+CrO42(aq)平衡右移,使c(CrO42)增大,同時c(H+)也增大,共同促使Cr2O72+H2O![]() 2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7,故答案為:c(H2SO4)增大,則c(SO42-)增大,與Ba2+生成沉淀,促使BaCrO4(s)
2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7,故答案為:c(H2SO4)增大,則c(SO42-)增大,與Ba2+生成沉淀,促使BaCrO4(s) ![]() Ba2+(aq)+CrO42(aq)平衡右移,c(CrO42)增大,同時c(H+)也增大,共同促使Cr2O72+H2O
Ba2+(aq)+CrO42(aq)平衡右移,c(CrO42)增大,同時c(H+)也增大,共同促使Cr2O72+H2O![]() 2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7;
2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7;
②. 根據表中各物質的溶度積常數可知,BaSO4與BaCrO4溶解度比較接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其難與H2SO4接觸,阻礙重鉻酸生成,故答案為:BaSO4與BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其難于接觸H2SO4,阻礙重鉻酸生成;
(4). 根據上述分析可知,沉淀BaCrO4并進一步回收重鉻酸的效果與溫度、濃度、溶液pH、硫酸濃度、沉淀顆粒等有關,受到溶液pH、溫度、H2SO4濃度、BaCrO4顆粒大小等因素的影響,故答案為:受到溶液pH、溫度、H2SO4濃度、BaCrO4顆粒大小等影響。
【題型】綜合題
【結束】
19
【題目】以Na2SO3溶液和不同金屬的硫酸鹽溶液作為實驗對象,探究鹽的性質和鹽溶液間反應的多樣性。
實驗 | 試劑 | 現象 | |
滴管 | 試管 | ||
| 0.2mol·L-1Na2SO3溶液 | 飽和Ag2SO4溶液 | Ⅰ.產生白色沉淀 |
0.2mol·L-1CuSO4 | Ⅱ.溶液變綠,繼續滴加產生棕黃色沉淀 | ||
0.1mol·L-1Al2(SO4)3溶液 | Ⅲ.開始無明顯變化,繼續滴加產生白色沉淀 | ||
(1)經驗檢,現象Ⅰ中的白色沉淀是Ag2SO3。用離子方程式解釋現象Ⅰ:__________。
(2)經檢驗,現象Ⅱ的棕黃色沉淀中不含![]() ,含有Cu+、Cu2+和
,含有Cu+、Cu2+和![]() 。
。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸證實沉淀中含有Cu+的實驗現象是__________。
②通過下列實驗證實,沉淀中含有Cu2+和![]() 。
。

a.白色沉淀A是BaSO4,試劑1是__________。
b.證實沉淀中含有Cu2+和![]() 的理由是__________。
的理由是__________。
(3)已知:Al2(SO3)3在水溶液中不存在。經檢驗,現象Ⅲ的白色沉淀中無![]() ,該白色沉淀既能溶于強酸,又能溶于強堿,還可使酸性KMnO4溶液褪色。
,該白色沉淀既能溶于強酸,又能溶于強堿,還可使酸性KMnO4溶液褪色。
①推測沉淀中含有亞硫酸根和__________。
②對于沉淀中亞硫酸根的存在形式提出兩種假設:
i.Al(OH)3所吸附;
ii.存在于鋁的堿式鹽中。對假設ii設計了對比實驗,證實了假設ii成立。
a.將對比實驗方案補充完整。
步驟一:

步驟二:__________(按上圖形式呈現)。
b.假設ii成立的實驗證據是__________。
(4)根據實驗,亞硫酸鹽的性質有__________。鹽溶液間反應的多樣性與__________有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據要求回答下列問題:
I. ①H、D、T ②H2O、D2O ③石墨、金剛石 ④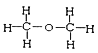 和
和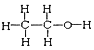
四組微粒或物質中,互為同位素的是_______;(填序號,下同)互為同素異形體的是_____。
II.現有①金剛石 ②干冰 ③Na2SO4 ④NH4Cl 四種物質,按下列要求回答:
(1)晶體熔化時需要破壞共價鍵的是_____(填序號,下同);
(2)熔點最低的是_______
(3)晶體中只存在一種微粒作用力是_______;
(4)屬于離子晶體的是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國明代《本草綱目》中收載藥物1892種,其中“燒酒”條目下寫道:“自元時始創其法,用濃酒和糟入甑,燕令氣.上……其清如水,味極濃烈,蓋酒露也。“”這里所用的“法”是指
A. 萃取 B. 滲析 C. 蒸餾 D. 升華
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗現象,所得結論錯誤的是( )
實驗 | 實驗現象 | 結論 |
A |
| 活動性:Al>Fe>Cu |
B |
| 銅與濃硝酸的反應產物是NO |
C |
| 增大反應物濃度,平衡向正反應方向移動 |
D |
| 裝置氣密性良好 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com