
【題目】在恒容密閉容器中,將10 mol CO和一定量的H2S混合加熱并達到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物質的量為8 mol。下列說法正確的是
COS(g)+H2(g) K=1,平衡后CO物質的量為8 mol。下列說法正確的是
A. CO.H2S的轉化率之比為1:1
B. 達平衡后H2S的體積分數為4%
C. 升高溫度,COS濃度減小,表明該反應是吸熱反應
D. 恒溫下向平衡體系中再加入CO.H2S.COS.H2各1 mol,平衡不移動
【答案】B
【解析】
反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,設反應前H2S物質的量為n,則:
CO(g)+H2S(g) ![]() COS(g)+H2(g)
COS(g)+H2(g)
起始(mol):10 n 0 0
變化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
該溫度下該反應的K=1,利用物質的量代替濃度代入平衡常數表達式計算出n,根據計算結果及化學平衡的影響因素進行判斷。
反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,設反應前H2S物質的量為n,則:
CO(g)+H2S(g) ![]() COS(g)+H2(g)
COS(g)+H2(g)
起始(mol):10 n 0 0
變化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
該溫度下該反應的K=1,設容器容積為V,則平衡常數K= ,
,
解得:n=2.5,即反應前硫化氫的物質的量為2.5mol;
A.由于反應前CO、H2S的物質的量分別為10mol、2.5mol,而二者化學計量數相等,反應消耗的物質的量相等,所以二者的轉化率一定不相等,故A錯誤;
B.該反應前后氣體的體積相等,則反應后氣體的總物質的量不變,仍然為10mol+2.5mol=12.5mol,平衡后硫化氫的物質的量為(2.5-2)mol=0.5mol,相同條件下氣體的體積分數=物質的量分數=0.5mol/12.5mol×100%=4.0%,故B正確;
C.升高溫度,COS濃度減小,說明平衡向著逆向移動,則該反應的正反應為放熱反應,故C錯誤;
D.恒溫下向平衡體系中再加入CO、H2S、COS、H2各1 mol,則此時該反應的濃度商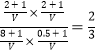 <1,說明平衡會向著正向移動,故D錯誤。
<1,說明平衡會向著正向移動,故D錯誤。
故選B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】鈦及鈦合金在航空航天領城具有重要的應用價值。鈦鐵礦主要成分為鈦酸亞鐵(FeTiO3),另含有少量SiO2、Fe2O3等雜質。以鈦鐵礦為原料制備鈦的工藝流程如下圖所示。

(1)為提高鈦鐵礦酸浸時的浸出率,除了采用循環浸取、延長時間、熔塊粉碎外,還可以采用______________________(寫一種方法)。
(2)硫酸質量分數對鈦、鐵浸出率的影響如圖所示,據此判斷,酸浸時所加硫酸的質量分數應為___________。

鈦鐵礦主要成分與濃硫酸反應的主要產物是TiOSO4和FeSO4,該反應的化學方程式:______________________。
(3)查閱資料可知:TiO2+與Fe3+水解轉化為沉淀的pH接近;反應①Fe3++H2Y2===FeY-+2H+,K=1024.3);反應②TiO2++H2Y2-=== TiO Y2-+2H+,K=1017.3。含鈦鐵溶液經EDTA(H2Y2-)處理后再調節pH,TiO2+水解生成偏鈦酸[TiO (OH)2]沉淀,則TiO2+水解的離子方程式為:___________;Fe3+未轉化為沉淀的原因是______________________。
(4)若將濾液2經___________冷卻結晶、過濾一系列操作還可獲得副產品綠礬(FsO4·7H2O)。濾液2經處理后,還可返回流程中使用的物質是______________________。
(5)利用下圖所示裝置在一定條件下由TiO2制取金屬鈦的化學方程式為__________________。陽極的電極反應式為______________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取氯氣有下列反應:2KMnO4+16HCl(濃)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)該反應中氧化劑是____;被還原的元素是______;氧化產物是_______。
(2)用單線橋法標出電子轉移的方向和數目:2KMnO4+16HCl(濃)=2MnCl2+2KCl+5Cl2↑+8H2O______
(3)該反應有1molKMnO4參加反應,被氧化的HCl為____mol,轉移電子____mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常用于混合物分離和提純的裝置,請根據裝置回答問題:

(1)在裝置C和D中都用到玻璃棒,裝置C中玻璃棒的作用是___________,裝置D中玻璃棒的作用是___________。
(2)裝置A中的①的名稱是是___________,冷卻水的方向是___________。裝置B在分液時為是液體順利滴下,應進行的操作是______________________。
(3)從氯化鈉溶液中得到氯化鈉固體,應選擇___________(填代表裝置圖的字母,下同);除去自來水中的Cl-等雜質,選擇裝置__________。檢驗自來水中Cl-是否除凈的方法:取少量錐形瓶中的水于潔凈試管中,滴加___________,不產生白色沉淀表明Cl-已除凈;從碘水中分離出I2,選擇裝置___________,該分離方法的名稱是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組按如下流程探究碘的制取,甲乙兩種制取方案如下:

(1)①分液漏斗使用前須檢漏,檢漏方法是_____________________。
②步驟X中,萃取后分液漏斗內觀察到的現象是_________________。
③下列有關步驟Y的說法正確的是_____。
a.應控制NaOH溶液的濃度和體積 b.將碘轉化成離子進入水層
c.主要是出去海帶浸取原液中的有機雜質 d.NaOH溶液可以有乙醇代替
④實驗中操作Z的名稱是___________。
(2)實驗甲中采用蒸餾不合理,理由是____________________________。
(3)①萃取所用到的玻璃儀器是________________。②萃取的原理是______________。舉例________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于原電池的敘述正確的是( )
A. 構成原電池的正極和負極必須是兩種不同的金屬
B. 原電池中陰離子一般向負極移動
C. 在原電池中,電子流出的一極是負極,該電極發生還原反應
D. 原電池放電時,電流的方向是從負極到正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種鋰釩氧化物熱電池裝置,電池總反應為xLi+LiV3O8=Li1+xV3O8。工作時,需先引發鐵和氯酸鉀反應使共晶體熔化,下列說法不正確的是

A. 組裝該電池應當在無水、無氧的條件下進行
B. 整個過程的能量轉化涉及化學能轉化為熱能和電能
C. 放電時LiV3O8電極反應為:xLi++LiV3O8-xe-=Li1+xV3O8
D. 充電時Cl移向LiV3O8電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1, 則反應HCl(g)=1/2H2(g)+1/2Cl2(g)的△H為
A. +184.6kJ·mol-1B. -92.3kJ·mol-1
C. -369.2kJ·mol-1D. +92.3kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學采用萃取-分液的方法從碘水中提取碘,主要操作步驟如下圖:
①該同學所采用的萃取劑可能是______(填序號)。
A. 酒精 B. 苯 C. 四氯化碳 D. 汽油
甲. 加入草取劑后振蕩 乙. 靜置分層
乙. 靜置分層 丙. 分離
丙. 分離
②甲、乙、丙3步實驗操作中,不正確的是____________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com