
【題目】中國的稀土資源十分豐富,有開采價值的儲量居世界第一。某實驗小組擬利用含鋁、硅、鐵等雜質的氟碳缽礦(主要成分為CeFCO3)制備三氯化鈰,設計如圖所示流程:
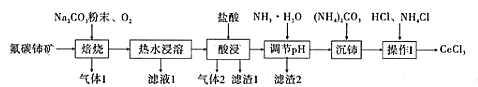
已知:①Ce2O3在加熱條件下能被氧氣氧化,生成難溶于水、具有強氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被還原成Ce3+。
③0.1mol·L-1金屬陽離子形成氫氧化物沉淀的pH如下:
金屬陽離子 | Fe3+ | Ce3+ | Al3+ |
開始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列問題:
(1)氟碳鈰礦中鈰的化合價為______,濾渣1的化學式為__________。
(2)焙燒氟碳鈰礦生成CeO3的化學方程式是____________。
(3)酸浸時產生氣體2的離子反應方程式是_______。
(4)為將鋁、鐵以濾渣2除去,用NH3·H2O調節酸浸后溶液的pH最大不能超過______。
(5)將沉鈰得到的Ce2(CO3)3·nH2O洗滌干凈后繼續進行操作I,簡述如何證明Ce2(CO3)3·nH2O已經洗滌干凈________。
(6)操作I是將得到的Ce2(CO3)3·nH2O加鹽酸至沉淀完全溶解,先經過蒸發濃縮、冷卻結晶、過濾、洗滌、干燥得到CeCl3·7H2O,再將該晶體與NH4Cl固體隔絕空氣共熱,得到無水CeCl3。其中,NH4Cl的作用是___________。
(7)產品純度測定:準確稱取CeCl3產品0.3750g于錐形瓶中,加入合適的氧化劑將Ce3+恰好完全氧化為Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 標準溶液滴定至終點,重復3次實驗,標準液的消耗體積分別為12.48mL、12.50mL、12.52mL。求該樣品的質量分數為_______(保留1位小數)。
【答案】+3 H2SiO3 4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2 2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O 7.6 取少量最后一次洗滌液于試管中,滴入稀HNO3、AgNO,若無白色沉淀產生,則已洗滌干凈 NH4Cl受熱分解生成HCl,抑制Ce3+的水解 82.2%
4NaF+4CeO2+6CO2 2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O 7.6 取少量最后一次洗滌液于試管中,滴入稀HNO3、AgNO,若無白色沉淀產生,則已洗滌干凈 NH4Cl受熱分解生成HCl,抑制Ce3+的水解 82.2%
【解析】
(1)根據化合價代數和為零進行分析;(2)據流程及題干信息分析;(3)類比MnO2與濃鹽酸的反應答題;(5)篩選溶液中存在少量均易檢出的Cl-證明;(6)利用水解反應原理解答;(7)取I平均值12.50mL進行計算。
(1)由氟碳缽礦的主要成分為CeFCO3,根據化合價代數和為零,F為-1價,CO32-為-2價,所以氟碳鈰礦中鈰的化合價為+3;因為含氟碳缽礦主要成分為CeFCO3,含有雜質鋁、硅、鐵等,根據框圖可知鋁、鐵氧化物能溶于酸,而硅酸鹽遇酸會形成難溶于水的H2SiO3,所以濾渣1為硅酸,其化學式為H2SiO3。故答案:+3;H2SiO3;
(2)焙燒氟碳鈰CeFCO3會和Na2CO3、O2反應生成CeO3和NaF、CO2,其化學方程式是4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2,故答案:4CeFCO3+2Na2CO3+O2
4NaF+4CeO2+6CO2,故答案:4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2;
4NaF+4CeO2+6CO2;
(3)CeO2在酸性條件下具有強氧化性,可以氧化Cl-為氯氣,其反應的離子方程式為2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O,故答案:2CeO2+8H++2Cl-=2Ce3++Cl2↑+4H2O;
(4)因為pH=2.8時,氫氧化鐵沉淀完全,pH=4.7時氫氧化鋁沉淀完全,pH=7.6時Ce(OH)3開始沉淀,所以為將鋁、鐵以濾渣2除去,用NH3·H2O調節酸浸后溶液的pH最大不能超過7.6,故答案:7.6;
(5)因為操作I加入了鹽酸和氯化銨,所以要判斷Ce2(CO3)3·nH2O是否已經洗滌干凈的方法:取少量最后一次洗滌液于試管中,滴入稀HNO3、AgNO,若無白色沉淀產生,則已洗滌干凈,故答案:取少量最后一次洗滌液于試管中,滴入稀HNO3、AgNO,若無白色沉淀產生,則已洗滌干凈;
(6)NH4Cl不穩定,加熱會分解生成氯化氫,Ce3+易水解生成Ce(OH)3,所以加NH4Cl的作用是受熱分解生成HCl,抑制Ce3+的水解,故答案:NH4Cl受熱分解生成HCl,抑制Ce3+的水解;
(7)標準液的消耗體積分別為12.48mL、12.50mL、12.52mL的平均值為12.50mL,根據Ce4++ Fe2+= Ce3++ Fe3+,所以n(Ce4+)=n( Fe2+)=12.50![]() 10-3 L
10-3 L![]() =1.250
=1.250![]() 10-3mol,所以該樣品的質量分數=
10-3mol,所以該樣品的質量分數=![]() 100%=82.2%。
100%=82.2%。


科目:高中化學 來源: 題型:
【題目】乙烯的產量是衡量一個國家石油化工發展水平的重要標志之一,以乙烯為原料合成的部分產品如圖所示。下列有關說法正確的是( )

A.氧化反應有①⑤⑥,加成反應有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.在加熱條件下,反應⑥的現象為產生磚紅色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組為了驗證SO2的還原性并測定產生SO2的質量,組裝了下圖裝置。回答下列問題:
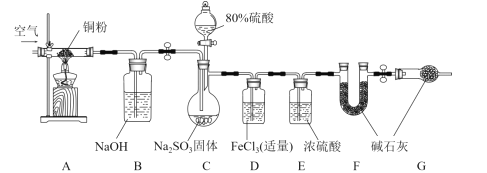
(1)C中發生反應的化學方程式是________,B裝置的名稱是_________,關于該套裝置說法正確的是_________(填標號)。
a 組裝儀器、加入藥品后檢查氣密性 b 實驗開始和最后時均需要通入空氣
c 利用A、B裝置是為了減小實驗誤差 d F、G中的堿石灰可以換為無水CaCl2
(2)甲同學認為很快可以看到D裝置的現象,他的依據是_________(用離子方程式表示)。乙同學做實驗時發現和甲同學預測的現象不一樣,先出現棕紅色,經過一段時間后變為淺綠色。于是查閱資料發現反應分為兩步:
第一步:![]() (快反應)
(快反應)
第二步:![]() (慢反應)
(慢反應)
如果需要驗證第一步反應是快反應,可以事先在D裝置中滴加數滴_________試劑,相應的實驗現象是________。
(3)學習小組通過實驗后D和F裝置中的數據來計算SO2的質量。D中加入足量的BaCl2溶液充分反應,經過________操作,測得沉淀為m1g,F的質量差為m2g,C中產生SO2的體積(標準狀況下)為_________L。該實驗的設計中,仍然存在系統誤差的可能原因是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
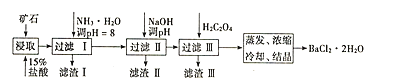
【題目】某礦石的主要成分為BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用該礦石制備BaCl22H2O的流程如圖,且三次濾渣的主要成分各不相同:
如表為常溫時各離子轉化為氫氧化物沉淀時的pH:
Fe3+ | Mg2+ | Ca2+ | |
開始沉淀時的pH | 1.9 | 9.1 | 11.9 |
完全沉淀時的pH | 3.2 | 11.1 | 13.9 |
(1)用15%鹽酸浸取前需充分研磨,目的是______。
(2)濾渣Ⅰ的主要成分為______;加入NaOH調pH的范圍為______;加入H2C2O4時應避免過量的原因是______。[已知難溶物質:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃時,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固體的溶液中加入高濃度的BaCl2溶液,有BaCO3沉淀生成,請寫出該反應的離子方程式______,該反應的平衡常數K=______。
(4)取制得的BaCl22H2O(含少量雜質)2.5g配成100mL溶液,取10.00mL該溶液于燒杯中,加入足量(NH4)2C2O4溶液,過濾,洗滌,將得到的BaC2O4沉淀用過量稀硫酸溶液溶解,過濾除去BaSO4沉淀,將所得的H2C2O4溶液移入錐形瓶,用0.05mol/L高錳酸鉀標準液滴定至終點。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高錳酸鉀標準液的儀器為______,滴入最后一滴高錳酸鉀溶液,錐形瓶中溶液顏色______,即說明達到滴定終點。
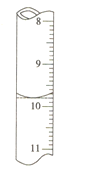
②若滴定前滴定管的讀數為1.80mL,滴定終點時滴定管中液面如圖,請計算BaCl22H2O的純度為______(保留3位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化合物與Cu+結合形成如圖所示的離子,則下列說法錯誤的是( )
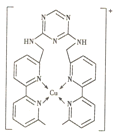
A.Cu+的核外電子排布式為[Ar]3d9
B.該離子中含有極性鍵、非極性鍵和配位鍵
C.該離子中碳原子的雜化方式有sp2、sp3兩種
D.該離子中無手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1980年,古迪的夫發明了鈷酸鋰材料,這種材料的結構可以使鋰離子在其中快速移動。以LiCoO2作電極材料的鋰離子電池在充、放電時的微觀粒子變化如圖所示,下列說法正確的是
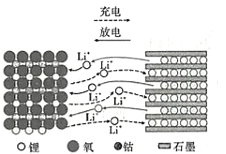
A.LiCoO2是電池的負極材料
B.充電時,LiCoO2電板的電勢低于石墨電極
C.充電時,陽極發生的反應是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放電時,當1mol電子轉移,則石墨電極質量減少7g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二茂鐵[Fe(C5H5)2]可用作火箭燃料添加劑、汽油的抗爆劑和橡膠的熟化劑,也可作紫外線吸收劑。可由環戊二烯(![]() )和FeCl2在三乙胺[(C2H5)3N]存在下反應制得。
)和FeCl2在三乙胺[(C2H5)3N]存在下反應制得。
(1)在元素周期表中,與Fe既同周期又同族且價層電子總數為10的元素是_____(填元素符號),該元索基態原子核外N層電子的自旋狀態_______(填“相同”或“相反”)。
(2)三乙胺中電負性最小的元素是________(填元素符號);C元素的_______雜化軌道與H元素的________軌道形成_______鍵。
(3)下列狀態的Cl中,電離最外層一個電子所需能量最大的是______(填序號)。
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)已知:分子中的大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成的大π鍵的電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成的大π鍵的電子數(如苯分子中的大π鍵可表示為![]() ),則環戊二烯負離子(
),則環戊二烯負離子(![]() )中的大π鍵應表示為________。
)中的大π鍵應表示為________。
(5)二茂鐵易升華且可溶于有機溶劑中,其晶體類型為________,二茂鐵的晶胞結構如圖所示(未畫出微粒),密度為pg·cm-3,則一個晶胞中Fe(C5H5)2。數目的計算表達式為______(設阿伏加德羅常數的值為NA)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某分子的結構如圖所示(-R 為烴基),其中 A、B、D 三種元素位于元素周期表中同一族的三個相鄰的周期,A 的非金屬性大于 B。D 與 G 形成的 DG3 在工業上可用于漂白和殺菌消毒。A 與 G 形成的 AG3 可完全水解,其水解的產物之一 H3AO3 常用作塑料件鍍金屬的還原劑。
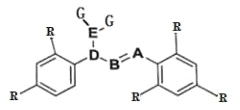
(1)具有未成對電子的原子或分子具有磁性。D 的某種氧化物 D2O4 的磁性大小與溫度呈正相關關系,即磁性是溫度的增函數。則 D2O4 ![]() 2DO2,ΔH______0(填“>”“<”或“=”)。
2DO2,ΔH______0(填“>”“<”或“=”)。
(2)DG3 用于殺菌消毒與 HGO 相比,DG3 可大大延長殺菌消毒的時間,試從反應速率理論和平衡移動理論兩者中選擇一個,解釋其原因____________________________。
(3)無機含氧酸中的非羥基氫不能發生電離。H3AO3 分子中 A 原子最外層的電子都參與了共價鍵的形成,試用方程式表示 H3AO3 的正鹽溶液呈堿性的原因_____。
(4)液氨中因存在2NH3(1) ![]() NH4++NH2-可導電,液態 D2O4 中也存在 D2O4
NH4++NH2-可導電,液態 D2O4 中也存在 D2O4![]() DO++DO3-,上述兩個過程的本質區別為___________。
DO++DO3-,上述兩個過程的本質區別為___________。
(5)T℃時,在一體積為 VL 的密閉容器中放入一定量的 ACl5 固體,按下式發生反應:ACl5(s)![]() ACl3(g)+Cl2(g),ΔH>0。測得容器內氣體的壓強變化如下表:
ACl3(g)+Cl2(g),ΔH>0。測得容器內氣體的壓強變化如下表:
時間 t/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 | ∞ |
總壓 P/kPa | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 5.0 | 5.0 |
上述條件下,以分壓表示的平衡常數 Kp=_____(kPa)2(計算結果保留兩位小數); 若保持溫度不變,30s 時給容器加壓,達新平衡后,容器內的總壓將_____(填“升高”、“降低”或“不變”);若將容器換成絕熱容器,加壓后容器內的總壓將_____(填“升高”、“降低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷的含氧酸有磷酸(H3PO4)、亞磷酸(H3PO3)、次磷酸(H3PO2)等多種,它們在工業上都是重要的化工原料。
(1)亞磷酸(H3PO3)是一種二元弱酸,寫出H3PO3與過量NaOH溶液反應的化學方程式:_______。某溫度下,0.01 mol L-1 H3PO3溶液的pH為2.7,該溫度下,H3PO3 的一級電離常數 Kal=_______。 (已知:lg2 = 0.3,lg3 = 0.5,lg5 = 0.7,H3PO3 的第二步電離忽略不計)
(2)某實驗小組用NaOH溶液處理含H3PO3廢水,當溶液中c (Na+) =c(H2PO3-) + 2c(HPO32-)時,溶液呈______性(填“酸”“堿”或“中”)。
(3)已知:常溫下,磷酸(H3PO4)的 Kal=7.ll×10-3、Ka2 = 6.23×10-8、Ka3 = 4.5 ×10-13, 則常溫下,Na2HPO4溶液中H2PO4-、HPO42-和PO43-的濃度由大到小的順序為________。
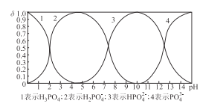
(4)向某濃度的磷酸溶液中滴加NaOH溶液,其pH與溶液中H3PO4、H2PO4-、HPO42-和PO43-的物質的量分數為δ (平衡時某物種的濃度與整個物種濃度之和的比值)的關系如圖所示。以酚酞為指示劑,當溶液由無色變為淺紅色時,發生主要反應的離子方程式是_________。
(5)已知:常溫下,Ksp(FePO4) = l.3×10-22、Ksp(A1PO4) = 5.2 ×10-19。常溫下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,當FePO4、AlPO4同時生成時,溶液中c(Fe3+):c(Al3+ ) =_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com