
下列關于實驗Ⅰ~Ⅳ的說法正確的是
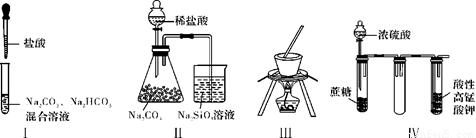
A. 實驗Ⅰ:逐滴滴加鹽酸時,試管中立即產生大量氣泡
B. 實驗Ⅱ:通過實驗現象可比較氯、碳、硅三種元素的非金屬性強弱
C. 實驗Ⅲ:本裝置可以用于從飽和食鹽水制取NaCl晶體
D. 實驗Ⅳ:酸性KMnO4溶液中有氣泡出現,且溶液顏色會逐漸變淺乃至褪去
 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源:2016-2017學年江蘇省高二學業水平測試化學試卷(解析版) 題型:選擇題
下列說法正確的是
A. 1molN2中含有的分子數為2×6.02×1023
B. 用激光筆照射CuSO4溶液可產生“丁達爾效應”
C. 常溫下,鋁片能溶于濃硝酸
D. 常溫下,淀粉溶液遇I2變成藍色
查看答案和解析>>
科目:高中化學 來源:2017屆黑龍江省哈爾濱市高三二模理科綜合化學試卷(解析版) 題型:實驗題
某學生欲探究FeSO4溶液與濃HNO3的反應。
該同學向盛有FeSO4溶液的試管中滴入數滴濃硝酸,并振蕩試管,預期現象為試管中會立即產生紅棕色氣體,溶液焰色逐漸變黃。但實際操作時觀察到液面上方氣體變化紅棕色,且試管中溶液顏色變為深棕色。
為了進一步探究溶液變為深棕色的原因,該同學進行如下實驗。
回答下列問題
(1)向FeSO4溶液和反應后溶液中加入KSCN溶液,前者不變紅色,后者變紅,該現象的結論是________。
(2)該同學通過查閱資料,認為溶液的深棕色可能是NO2或NO與溶液中Fe2+或Fe3+發生反應而得到的。為此他利用如圖裝置(氣密性已檢驗,尾氣處理裝備略)進行探究。
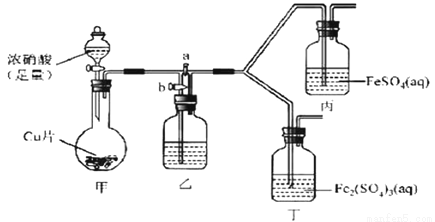
Ⅰ.打開活塞a、關閉b,并使甲裝置中反應開始后,觀察到丙中溶液逐漸變為深棕色,而丁中溶液無明顯變化。
Ⅱ.打開活塞b、關閉a,一段時間后再停止甲中反應。
Ⅲ.為與Ⅰ中實驗進行對照重新更換丙、丁后,使甲中反應重復進行步驟Ⅰ實驗,觀察到的現象與步驟Ⅰ中相同。
①銅與足量濃硝酸反應的離子方程式是_______________。
②裝置乙的試劑為____________________。
③步驟Ⅱ的目的是_______________________。
④該實驗可得出的結論是______________________。
(3)該同學重新進行FeSO4溶液與濃HNO3的反應的實驗,觀察到了預期現象,其實驗操作是_________,反應的離子方程式為___________________
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三適應性月考(六)理綜化學試卷(解析版) 題型:選擇題
下列根據實驗操作和現象所得出的結論,正確的是
選項 | 實驗操作及現象 | 結論 |
A | 測定等物質的量濃度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 作金屬性:S>C |
B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液,紫紅色褪色 | CH2=CHCH2OH 中含有碳碳雙鍵 |
C | 將0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀產生,再滴加0.1 mol·L-1CuSO4溶液,沉淀變為淺藍色 | 同溫下,Ksp[Mg(OH)2]> Ksp[Cu(OH)2] |
D | 將某化合物在酒精燈上進行焰色反應,透過藍色鈷玻璃觀察為紫色 | 該化合物一定是鉀鹽 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三下學期周練(四)理科綜合化學試卷(解析版) 題型:填空題
二氧化碳和氨是重要的化工產品,是純堿工業、制造硝酸、銨鹽和氮肥等的原料。
(1)CO2的電子式是 。
(2)以NH3與CO2為原料合成尿素[化學式為CO(NH2)2]的主要反應如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
寫出CO2與NH3合成尿素和液態水的熱化學反應方程式 ;
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同溫度下NO產率如下圖1所示,由此圖可知溫度對NO產率的影響規律為 ,請用化學反應速率和化學平衡理論解釋其原因: 。
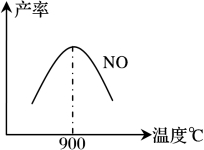
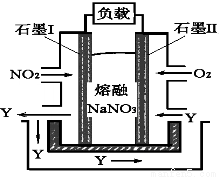
圖1 圖2
(4)以NO2、O2、熔融NaNO3組成的燃料電池裝置如圖2所示,在使用過程中石墨I電極反應生成一種氧化物Y,有關石墨I電極反應可表示為_______________。
(5)已知常溫下NH3·H2O的電離平衡常數K=1.75×10-5,H2CO3的電離平衡常數K1=4.4×10-7,K2=4.7×10-11。 常溫下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液顯__________(填“酸性”、“中性”或“堿性”);計算反應NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常數K= (結果保留2位有效數字)。
NH3·H2O+H2CO3的平衡常數K= (結果保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省貴陽市高三下學期第六次適應性考試理綜化學試卷(解析版) 題型:簡答題
2015年10月,中國科學家坩呦呦獲得了2015年度諾貝爾生理學或醫學獎,獲獎理由是“因為發現青蒿素——一種用于治療瘧疾的藥物,挽救了全球特別是發展中國家的數百萬人的生命”。已知青蒿素的一種化學合成方法的部分工藝流程如圖24:
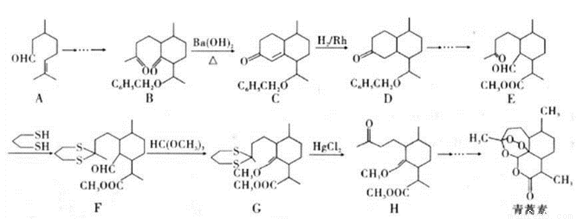
已知:①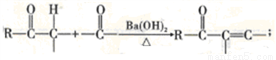
②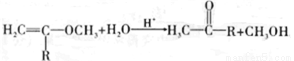
請冋答下列問題:
(1)下列有關說法正確的是_______(填序號)。
A.青蒿素屬于環狀化合物,但不屬于芳香族化合物
B.青蒿素易溶于水,難溶于乙醇、苯等
C.一定條件下,青蒿素能與氫氧化鈉溶液反應
D.青蒿素遇濕潤的淀粉碘化鉀試紙立刻顯藍色,是因為分子結構中含有酯基
(2)化合物A中含有的非含氧官能團的名稱是_______,請選擇下列合適的試劑來檢驗該官能團,試劑加入的正確順序為____。
A.溴水 B.稀鹽酸
C.新制氫氧化銅懸濁液 D.氫氧化鈉溶液
(3)該工藝流程中設計E→F、G→H的目的是_________________。
(4)H與稀硫酸共熱時反應的化學方程式為_____________________。
(5)M與A互為同系物,但比A少兩個碳原子。滿足下列條件的M的同分異構體有______種(不考慮立體異構)。
①含有六元環 ②能發生銀鏡反應
(6)請結合所學知識和上述信息,寫出以笨甲醛和氯乙烷為原料,制備芐基乙醛(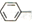 CH2CH2CHO)的路線流程圖。_______________________(無機試劑任選,合成路線流程圖示例如下:
CH2CH2CHO)的路線流程圖。_______________________(無機試劑任選,合成路線流程圖示例如下: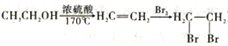 )
)
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省貴陽市高三下學期第六次適應性考試理綜化學試卷(解析版) 題型:選擇題
短周期A、B、C、D、E五種主族元素,原子序數依次增大,B、C、E最外層電子數之和為11,A原子最外層電子數是次外層電子數的2倍,C是同周期中原子半徑最大的元素,工業上一般通過電解氧化物的方法獲得D的單質,E單質是制備太陽能電池的重要材料。下列說法正確的是
A. 相同質量的C和D單質分別與足量稀鹽酸反應時,后者生成的氫氣多
B. C與D的最高價氧化物對應的水化物的堿性相比,后者更強
C. 不用電解氯化物的方法制備單質D是由于其氯化物的熔點高
D. 簡單離子半徑:B<C
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二下學期第一次月考化學試卷(解析版) 題型:選擇題
下列化學用語表達正確的是( )
A.HCl的電子式為H+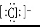 B.S2-的結構示意圖為
B.S2-的結構示意圖為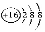
C.O-16原子的符號為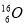 D.
D.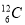 、
、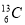 、
、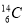 含有相同的中子數
含有相同的中子數
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二3月月考化學試卷(解析版) 題型:選擇題
下列關于有機化合物的結構、性質的敘述正確的是( )
A. 糖類、油脂、蛋白質的水解產物都是非電解質
B. 淀粉和纖維素的分子式均為(C6H10O5)n,二者互為同分異構體
C. 纖維素、甘油分別在濃硫酸存在時與濃硝酸的反應屬于同一類型的反應
D. 乙醇、乙酸和苯酚的分子中均含有官能團—OH,所以均能與NaOH溶液反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com