
【題目】化學與人類生活、生產和社會可持續發展密切相關,下列敘述正確的是( )
A.水泥、玻璃、青花瓷、水晶、瑪瑙都屬于硅酸鹽工業產品
B.氧化鋁和氧化鎂都是電解質,工業上可用于電解制取鋁和鎂
C.用純堿制玻璃、用鐵礦石煉鐵、用氨制碳酸銨都會產生溫室氣體
D.靜電除塵、燃煤固硫、汽車尾氣催化凈化都可以提高空氣質量
 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:
【題目】某工廠的廢氣中含有CO、SO2、NO等有毒氣體,為了更有效地治理該廢氣,某研究小組分別設計了如下兩個方案:
方案(1):治理含CO、SO2的煙道氣,以Fe2O3作催化劑,將CO、SO2在380℃時轉化為S和一種無毒氣體。
已知:ⅰ.硫的熔點112.8℃,沸點444.6℃;
ⅱ.反應每得到1mol硫,放出270kJ的熱量。
①寫出該治理煙道氣反應的熱化學方程式: 。
②其他條件相同,催化劑不同時,上述反應中SO2的轉化率隨反應溫度的變化如下圖。不考慮催化劑價格因素,生產中選Fe2O3作催化劑的主要原因是 。
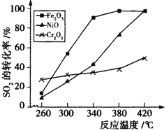
方案(2):用活性炭還原法處理氮氧化物,有關反應為:C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某容積為2L 的密閉容器中加入NO和足量的活性炭(固體試樣體積忽略不計),恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g)。向某容積為2L 的密閉容器中加入NO和足量的活性炭(固體試樣體積忽略不計),恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反應速率為 。
②根據表中數據,T1℃時該反應的平衡常數為 (保留兩位有效數字)。
③下列各項能作為判斷該反應達到平衡狀態標志的是 (填序號字母)。
A.容器內壓強保持不變
B.2v正(NO)=v逆(N2)
C.容器內CO2的體積分數不變
D.混合氣體的密度保持不變
④30min時改變某一條件,反應重新達到平衡,則改變的條件可能是 ;
⑤一定溫度下,隨著NO的起始濃度增大,NO的平衡轉化率 (填“增大”、“減小”或“不變”)
⑥50min時,保持其他條件不變,往容器中再充入0.32 mol NO和0.34mol CO2,平衡將向 方向移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于能量轉換的認識中不正確的是
A.電解水生成氫氣和氧氣時,電能轉化為化學能
B.白熾燈工作時,電能全部轉化為光能
C.煤燃燒時,化學能主要轉化為熱能
D.綠色植物進行光合作用時,太陽能轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中,充入SO2和18O原子組成的氧氣,在一定條件下開始反應,在達到平衡后,18O存在于( )
A.只存在于氧氣中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,屬于氧化還原反應同時又是吸熱反應的是
A.Ba(OH)2·8H2O與NH4Cl反應
B.鋁與鹽酸反應
C.灼熱的炭與CO2反應
D.甲烷與O2的燃燒反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀銅合金廣泛用于航空工業。從切割廢料中回收并制備銅化工產品的工藝如下:

(注:Al(OH)3和Cu(OH)2開始分解的溫度分別為450℃和80℃)
(1)電解精煉銀時,陰極反應式為 ;濾渣A與稀HNO3反應,產生的氣體在空氣中迅速變為紅棕色,該氣體變色的化學方程式為 。
(2)固體混合物B的組成為 ;在生成固體B的過程中,需控制NaOH的加入量,若NaOH過量,則因過量引起的反應的離子方程式為 。
(3)完成煅燒過程中一個反應的化學方程式: CuO+ Al2O3![]() CuAlO2+ ↑。
CuAlO2+ ↑。
(4)若銀銅合金中銅的質量分數為63.5%,理論上5.0kg廢料中的銅可完全轉化為 molCuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制備膽礬,其基本操作是 、過濾、洗滌和干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學組裝了如圖所示的電化學裝置,電極Ⅰ為Al,其它均為Cu,則( )

A.電極Ⅱ逐漸溶解
B.電極Ⅰ發生還原反應
C.電流方向:電極Ⅳ→A→電極Ⅰ
D.電極Ⅲ的電極反應:Cu2+ + 2e- = Cu
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將煤轉化為水煤氣的主要化學反應為C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
C(s)、CO(g)和H2(g)完全燃燒的熱化學方程式為:
C(s)+O2(g)═CO2(g);△H=﹣393.5kJmol﹣1
H2(g)+![]() O2(g)═H2O(g);△H=﹣242.0kJmol﹣1
O2(g)═H2O(g);△H=﹣242.0kJmol﹣1
CO(g)+![]() O2(g)═CO2(g);△H=﹣283.0kJmol﹣1
O2(g)═CO2(g);△H=﹣283.0kJmol﹣1
請回答:(1)根據以上數據寫出C(s)與水蒸氣反應的熱化學反應方程式: .
(2)比較反應熱數據可知,1mol CO(g)和1mol H2(g)完全燃燒放出的熱量之和比1mol C(s)完全燃燒放出的熱量多.甲同學據此認為“煤轉化為水煤氣可以使煤燃燒放出更多的熱量”;乙同學根據蓋斯定律做出右面循環圖:并據此認為“煤轉化為水煤氣再燃燒放出的熱量與煤直接燃燒放出的熱量相等”.請分析:甲、乙兩同學觀點正確的是 (填“甲”或“乙”);判斷的理由是 .

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等.下列判斷不正確的是( )

A. 最簡單氣態氫化物的熱穩定性:R>Q
B. 最高價氧化物對應水化物的酸性:Q<W
C. 原子半徑:T>Q>R
D. 簡單離子半徑:T>R
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com