
合成氨工業對化學工業和國防工業有重要的意義,對我國實現農業現代化起著重要的作用。關于合成氨工業的說法正確的是
A.合成氨反應一般選擇在500℃左右的溫度下進行,只是因為考慮到催化劑的催化活性
B. 合成氨工業必須使用鐵觸媒作催化劑
C.目前我國的合成氨工業一般采用的條件是:T,500℃左右;P,20MPa―50 MPa ,這時平衡混合物中氨的體積分數已接近100%
D.有研究表明,在400℃、壓強超過200MPa時,不必使用催化劑氨的合成反應就能順利進行
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2008?佛山一模)(1)合成氨工業對化學工業和國防工業具有重要意義.工業合成
(2008?佛山一模)(1)合成氨工業對化學工業和國防工業具有重要意義.工業合成| 20-50MPa | 500℃、鐵觸煤 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(1)合成氨工業對化學工業和國防工業具有重要意義。工業合成氨生產示意圖如圖甲所示。
①X的化學式為__________,屬于________(填“極性”或“非極性”)分子。
②圖甲中條件選定的主要原因是(選填字母序號,下同)________。
A.溫度、壓強對化學平衡的影響
B.鐵觸媒在該溫度時活性大
C.工業生產受動力、材料、設備等條件的限制
③改變反應條件,會使平衡發生移動。圖乙表示隨條件改變,氨氣的百分含量的變化趨勢。當橫坐標為壓強時,變化趨勢正確的是________,當橫坐標為溫度時,變化趨勢正確的是__________。
(2)常溫下氨氣極易溶于水,其水溶液可以導電。
①用方程式表示氨氣溶于水的過程中存在的可逆反應:
___________________________________________________________________。
②氨水中水電離出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③將氨水和鹽酸混合后,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
Ⅱ、若上述關系中C是正確的,則溶液中溶質的化學式是 。
Ⅲ、若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(3)氨氣具有還原性,在銅的催化作用下,氨氣和氟氣反應生成X和Y兩種物質。X為銨鹽,Y在標準狀況下為氣態。在此反應中,若每反應1體積氨氣,同時反應0.75體積氟氣;若每反應8.96 L氨氣(標準狀況),同時生成0.3 mol X。
①寫出氨氣和氟氣反應的化學方程式: ___________________________________。
②在標準狀況下,每生成1 mol Y,轉移電子的物質的量為___________mol。
(4)已知液態NH3與H2O相似,也可以發生微弱的電離,電離出含有相同電子數的微粒,則液態NH3的電離方程式為:
查看答案和解析>>
科目:高中化學 來源:2010年四川省瀘州天立學校高二上學期期中考試化學試卷 題型:實驗題
(1)合成氨工業對化學工業和國防工業具有重要意義。工業合成氨生產示意圖如圖甲所示。
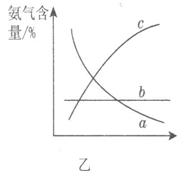
①X的化學式為__________,屬于________(填“極性”或“非極性”)分子。 ②圖甲中條件選定的主要原因是(選填字母序號,下同)________。
②圖甲中條件選定的主要原因是(選填字母序號,下同)________。
A.溫度、壓強對化學平衡的影響
B.鐵觸媒在該溫度時活性大
C.工業生產受動力、材料、設備等條件的限制
③改變反應條件,會使平衡發生移動。圖乙表示隨條件改變,氨氣的百分含量的變化趨勢。當橫坐標為壓強時,變化趨勢正確的是________,當橫坐標為溫度時,變化趨勢正確的是__________。
(2)常溫下氨氣極易溶于水,其水溶液可以導電。
①用方程式表示氨氣溶于水的過程中存在的可逆反應:
___________________________________________________________________。
②氨水中水電離出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③將氨水和鹽酸混合后, 某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
Ⅱ、若上述關系中C是正確的,則溶液中溶質的化學式是 。
Ⅲ、若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(3)氨氣具有還原性,在銅的催化作用下,氨氣和氟氣反應生成X和Y兩種物質。X為銨鹽,Y在標準狀況下為氣態。在此反應中,若每反應1體積氨氣,同時反應0.75體積氟氣;若每反應8.96 L氨氣(標準狀況),同時生成0.3 mol X。
①寫出氨氣和氟氣反應的化學方程式: ___________________________________。
②在標準狀況下,每生成1 mol Y,轉移電子的物質的量為___________mol。
(4)已知液態NH3與H2O相似,也可以發生微弱的電離,電離出含有相同電子數的微粒,則液態NH3的電離方程式為:
查看答案和解析>>
科目:高中化學 來源:2010年四川省瀘州天立學校高二上學期期中考試化學試卷 題型:實驗題
(1)合成氨工業對化學工業和國防工業具有重要意義。工業合成氨生產示意圖如圖甲所示。


①X的化學式為__________,屬于________(填“極性”或“非極性”)分子。
②圖甲中條件選定的主要原因是(選填字母序號,下同)________。
A.溫度、壓強對化學平衡的影響
B.鐵觸媒在該溫度時活性大
C.工業生產受動力、材料、設備等條件的限制
③改變反應條件,會使平衡發生移動。圖乙表示隨條件改變,氨氣的百分含量的變化趨勢。當橫坐標為壓強時,變化趨勢正確的是________,當橫坐標為溫度時,變化趨勢正確的是__________。
(2)常溫下氨氣極易溶于水,其水溶液可以導電。
①用方程式表示氨氣溶于水的過程中存在的可逆反應:
___________________________________________________________________。
②氨水中水電離出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③將氨水和鹽酸混合后, 某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
Ⅱ、若上述關系中C是正確的,則溶液中溶質的化學式是 。
Ⅲ、若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(3)氨氣具有還原性,在銅的催化作用下,氨氣和氟氣反應生成X和Y兩種物質。X為銨鹽,Y在標準狀況下為氣態。在此反應中,若每反應1體積氨氣,同時反應0.75體積氟氣;若每反應8.96 L氨氣(標準狀況),同時生成0.3 mol X。
①寫出氨氣和氟氣反應的化學方程式: ___________________________________。
②在標準狀況下,每生成1 mol Y,轉移電子的物質的量為___________mol。
(4)已知液態NH3與H2O相似,也可以發生微弱的電離,電離出含有相同電子數的微粒,則液態NH3的電離方程式為:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com