
分析 Ⅰ.(1)定容時俯視刻度線,溶液體積V偏小,結合c=$\frac{n}{V}$分析;
(2)依據n=cV計算NaOH的質量,c=$\frac{n}{V}$計算B溶液中c(Na+);
(3)過濾時玻璃棒的作用是引流;
Ⅱ.(4)制得的樣品含MgaAlb(OH)c(CO3)d0.1mol,用1mol/L的鹽酸使其完全溶解,消耗鹽酸的體積為1.8L;同時生成2.24L(標準狀況)CO2,此時溶液中只含AlCl3和MgCl2兩種溶質,碳元素守恒計算得到碳酸根離子物質的量,利用氯化氫物質的量計算和氫氧根離子反應的氯化氫物質的量,確定氫氧根離子物質的量,根據化合物化合價代數和為0計算得到abcd確定化學式.
解答 解:Ⅰ.(1)定容時俯視刻度線,溶液體積V偏小,c=$\frac{n}{V}$可知,n不變,V偏小,則c偏大,
故答案為:偏大;
(2)因為B溶液為c(NaOH)=1.6mol•L-1和c(Na2CO3)=0.8mol•L-1的混合溶液,則NaOH的質量m=40n=40cV=40×1.6×0.5=32.0g,
c(Na+)=$\frac{n}{V}$=$\frac{1.6×0.5+0.8×0.5×2}{0.5}$=3.2mol•L-1,
故答案為:32.0g;3.2;
(3)將(1)和(2)所配溶液混合后,過濾即得水滑石,過濾時玻璃棒的作用是引流,
故答案為:引流;
Ⅱ.(4)制得的樣品含MgaAlb(OH)c(CO3)d0.1mol,用1mol/L的鹽酸使其完全溶解,消耗鹽酸的體積為1.8L;同時生成2.24L(標準狀況)CO2,此時溶液中只含AlCl3和MgCl2兩種溶質,
n(CO32-)=n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol
d=$\frac{n(C{{O}_{3}}^{2-})}{n(水滑石)}$=$\frac{0.1mol}{0.1mol}$=1
n(HCl)=cV=1mol/L×1.8L=1.8mol
c=$\frac{n(HCl)-2n(C{{O}_{3}}^{2-})}{n(水滑石)}$=$\frac{1.8mol-2×0.1mol}{0.1mol}$=16
根據化合物化合價代數和為0可得2a+3b=18
結合a+b+c+d=25可得a=6,b=2
所以水滑石的化學式為Mg6Al2(OH)16CO3,
答:該水滑石的化學式為Mg6Al2(OH)16CO3.
點評 本題考查了配制一定物質的量濃度的溶液的方法及其計算、化學式確定方法,明確配制原理和過程是解題關鍵,注意基本公式的應用,題目難度中等.


科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在一定溫度下AgCl水溶液中,Ag+和Cl-濃度的乘積是一個常數 | |
| B. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固體的溶液中,c(Ag+)=c(Cl-)且Ag+與Cl-濃度的乘積等于1.8×10-10 mol2•L-2 | |
| C. | 溫度一定時,當溶液中Ag+和Cl-濃度的乘積等于Ksp值時,此溶液為AgCl的飽和溶液 | |
| D. | 向2.0mL濃度均為0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1 AgNO3溶液,振蕩,沉淀呈黃色,說明AgCl的Ksp比AgI的Ksp小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:
苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔點/℃ | 122.4 | -97 | -12.3 |
| 沸點/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
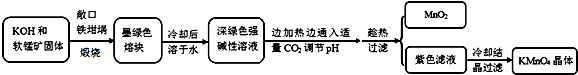
| 物質 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
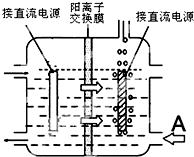
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
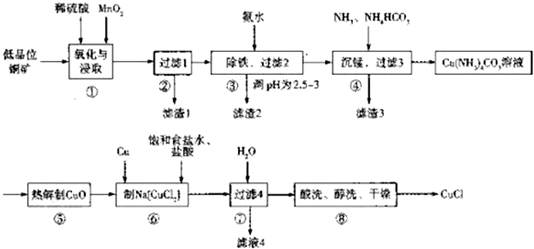
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Ⅰ.(1)某學習小組用0.80mol/L標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸.
Ⅰ.(1)某學習小組用0.80mol/L標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸.| 實驗編號 | 待測鹽酸溶液的體積/mL | 滴入NaOH溶液的體積/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com