
用石灰乳、石灰氮(CaCN2)和煉廠氣(含H2S)反應,既能凈化尾氣,又能獲得應用廣泛的CS(NH2)2(硫脲),其部分工藝流程如下:
(1)高溫下,H2S存在下列反應:2H2S(g)  2H2(g)+S2(g),其平衡常數表達式為K=。
2H2(g)+S2(g),其平衡常數表達式為K=。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低溫下進行,其原因是 ;過濾得到的濾渣可再利用,濾渣的主要成分是 (填化學式)。
(3)合成硫脲需長時間攪拌,并在較高溫度(80℃-85℃)下進行,其目的是 。
Ca(HS)2與CaCN2在水溶液中合成硫脈的化學方程式為 。
(4)化合物X與硫脲互為同分異構體,X加入FeCl3溶液中,溶液顯紅色,X的化學式為 。
(1)c2(H2)·c(S2)/c2(H2S)
(2)溫度低H2S溶解量大,溶液中H2S濃度高,有利于吸收;Ca(OH)2[或Ca(OH)2和CaS]
(3)使反應物充分接觸,維持較高溫度,有利于提高反應速率
Ca(HS)2+2CaCN2+6H2O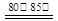 2CS(NH2)2 + 3Ca(OH)2
2CS(NH2)2 + 3Ca(OH)2
(4)NH4SCN
解析試題分析:(1)K的表達式為生成物濃度的次方除以反應物濃度的次方。(2)氣體在水中的溶解度,隨著溫度的升高而減小。石灰乳中Ca(OH)2的濃度較大,吸收H2S后,一般仍有剩余,可以再利用。(3)接觸面積大,溫度高均可以提高反應速率。由(2)的提示知,石灰乳吸收H2S生成Ca(HS)2進入“合成”階段,箭頭指入為加入反應物,則CaCN2和H2O均為反應物,由元素守恒知,生成CS(NH2)2外還有Ca(OH)2。(4)與FeCl3溶液,溶液顯紅色,應為SCN-,同分異構體的化學式相同,由原子種類和數目可以確定還有NH4+ ,則為NH4SCN。
考點:化學工藝流程、元素及化合物、化學基本理論


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案科目:高中化學 來源: 題型:填空題
以白云石(化學式表示為MgCO3·CaCO3)為原料制備氫氧化鎂的工藝流程如下:

(1)根據流程圖判斷白云石“輕燒”后固體產物的主要成份 _____ 。則“輕燒”溫度應不超過 _____ 。
(2)流程圖中“加熱反應”的化學方程式為 _ _________________________ 。
(3)沉淀過程溶液的pH=9.5,此時溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)該工藝中可以循環使用的物質是 、 (填化學式)。
(5)傳統工藝將白云石分解為氧化鎂和氧化鈣后提取,該工藝采用輕燒白云石 的方法,其優點是 、 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
分子篩具有均勻的微孔結構,分子篩篩分作用見下圖。由于分子篩具有吸附能力高,熱穩定性強等其它吸附劑所沒有的優點,使得分子篩獲得廣泛的應用。某種型號的分子篩的工業生產流程可簡單表示如下:

在加NH3·H2O調節pH的過程中,若pH控制不當會有Al(OH)3生成,假設生產流程中鋁元素和硅元素均沒有損耗,鈉原子的利用率為10%。
(1)分子篩的孔道直徑為4A(1 A=10-10m)稱為4A型分子篩,當Na+被Ca2+取代時就制得5A型分子篩,當Na+被K+取代時就制得3A型分子篩。要高效分離正丁烷(分子直徑為4.65A)和異丁烷(分子直徑為5.6A)應該選用 型分子篩。
(2)A12(SO4)3溶液與Na2SiO3溶液反應生成膠體的離子方程式為
(3)該生產流程中所得濾液里含有的離子除H+、OH-外,主要為 ;檢驗其中金屬陽離子的操作方法是
(4)加NH3·H2O調節pH后,加熱到90℃并趁熱過濾的原因可能是
(5)該生產流程中所得分子篩的化學式為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
回收再利用鍺產品加工廢料,是生產GeO2的重要途徑,其流程如下圖:
(1)Ge2+與氧化劑H2O2反應生成Ge4+,寫出該反應的離子方程式 。
(2)蒸餾可獲得沸點較低的GeCl4,在此過程中加入濃鹽酸的原因是 。實驗室蒸餾操作時常用的玻璃儀器有:酒精燈、蒸餾燒瓶、 、 、接收管、錐形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此過程用化學方程式可表示為 。
溫度對GeCl4的水解率產生的影響如圖1所示,其原因是 。 為控制最佳的反應溫度,實驗時可采取的措施為 (填序號)。
A.用冰水混合物 B.49℃水浴 C.用冰鹽水
(4)結合Ge在元素周期表中的位置及“對角線”法則,分析GeO2溶解率隨pH 變化的原因 ,用離子方程式表示pH>8時GeO2溶解率增大可能發生的反應 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
磷酸亞鐵鋰LiFePO4是一種新型汽車鋰離子電池的電極材料。某化工廠以鐵紅、鋰輝石LiAl(SiO3)2(含少量Ca2+、Mg2+的鹽)、碳粉等原料來生產磷酸亞鐵鋰。其主要工藝流程如下: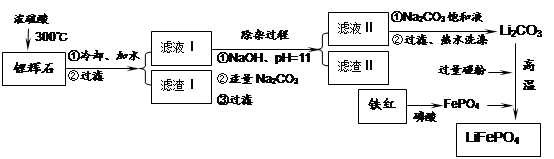
已知:2LiAl(SiO3)2 + H2SO4(濃) 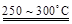 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| 溫度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
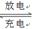 LiFePO4,電池中的固體電解質可傳導Li+。試寫出該電池放電時的正極反應: 。若用該電池電解飽和食鹽水(電解池電極均為惰性電極),當電解池兩極共有4480mL氣體(標準狀況)產生時,該電池消耗鋰的質量為 。
LiFePO4,電池中的固體電解質可傳導Li+。試寫出該電池放電時的正極反應: 。若用該電池電解飽和食鹽水(電解池電極均為惰性電極),當電解池兩極共有4480mL氣體(標準狀況)產生時,該電池消耗鋰的質量為 。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以地下鹵水(主要含NaCl,還有少量Ca2+、Mg2+)為主要原料生產亞硫酸鈉的新工藝如下,同時能得到用作化肥的副產品氯化銨。
已知以下四種物質的溶解度曲線圖:
(1)“除雜”時,先加入適量石灰乳過濾除去Mg2+,再通入CO2并用少量氨水調節pH過濾除去Ca2+,“廢渣”的主要成分為 、 。
(2)“濾渣1”的化學式為 。
(3)在“濾液1”中加入鹽酸的目的是 。“濾渣2”的化學式為 。
(4)已知H2CO3和H2SO3的電離常數如下表,“通入SO2”反應的化學方程式為 。
| 物質 | 電離常數(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在硫酸工業生產中,為了有利于SO2的轉化,且能充分利用熱能,采用了中間有熱交換器接觸室(見圖)。按此密閉體系中氣體的流向,則在A處流出的氣體為( )
| A.SO2 | B.SO3、O2 | C.SO2、SO3 | D.SO2、O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氮化鋁(AlN)具有耐高溫、抗沖擊、導熱性好等優良性質,被廣泛應用于電子工業、陶瓷工業等領域。在一定條件下,氮化鋁可通過如下反應合成:Al2O3+N2+3C=2AlN+3CO,下列敘述正確的是( )。
| A.在氮化鋁的合成反應中,N2是還原劑,Al2O3是氧化劑 |
| B.上述反應中每生成2 mol AlN,N2得到3 mol電子 |
| C.氮化鋁中氮元素的化合價為-3價 |
| D.氮化鋁屬于復合材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
為了同時施用分別含氮、磷、鉀三種元素的化肥,對于提供的化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最適宜的組合是( )
| A.①②③④ | B.②③④ | C.①②③ | D.③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com