
 .
. .
.分析 A、B、C、D為短周期中相鄰兩周期中的元素,其原子序數A>B>C>D,B的氣態氫化物的分子式為H2B,則B是第ⅥA族元素,最高價是+6價,即最高價氧化物是BO3,設B的質子數是x,則$\frac{2x}{2x+48}$=40%,解得x=16,所以B是S元素;C和A、B在同一周期,即處于第三周期,B與A左右相鄰,則A為Cl;D和A形成簡單離子后,它們電子層相差兩層,而n-m=6,所以m=1,則D是Li元素;C和A可形成CA3型化合物,且C的原子序數小于B的,結合(5)中能與鹽酸反應,則C應該是Al元素,據此解答.
解答 解:A、B、C、D為短周期中相鄰兩周期中的元素,其原子序數A>B>C>D,B的氣態氫化物的分子式為H2B,則B是第ⅥA族元素,最高價是+6價,即最高價氧化物是BO3,設B的質子數是x,則$\frac{2x}{2x+48}$=40%,解得x=16,所以B是S元素;C和A、B在同一周期,即處于第三周期,B與A左右相鄰,則A為Cl;D和A形成簡單離子后,它們電子層相差兩層,而n-m=6,所以m=1,則D是Li元素;C和A可形成CA3型化合物,且C的原子序數小于B的,結合(5)中能與鹽酸反應,則C應該是Al元素.
(1)若n-m=6,則A與D形成化合物是LiCl,屬于離子化合物,電子式為 ,
,
故答案為: ;
;
(2)D位于第二周期第m族,所以原子序數是m+2,故答案為:m+2;
(3)Al3+離子結構示意圖為 ,故答案為:
,故答案為: ;
;
(4)向H2S的水溶液中滴入氯氣的水溶液,發生反應的化學方程式為:H2S+Cl2=S↓+2HCl,
故答案為:H2S+Cl2=S↓+2HCl;
(5)向HCl的水溶液中投入Al的單質,反應的離子方程式為:2Al+6H+=2Al3++3H2↑,
故答案為:2Al+6H+=2Al3++3H2↑.
點評 本題考查結構性質位置關系應用,關鍵是推斷元素,注意根據問題確定C為Al,屬于中等難度的試題,側重對基礎知識的鞏固與檢驗,有利于培養學生的邏輯思維能力和發散思維能力.


科目:高中化學 來源: 題型:解答題
 +CH3COCHCOOC2H5$→_{10℃攪拌12h}^{濃H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃攪拌12h}^{濃H_{2}SO_{4}}$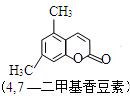

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增加.其中A與B、A與D在周期表中位置相鄰,A原子核外有兩個未成對電子,B元素的第一電離能比同周期相鄰兩個元素都大,C原子在同周期原子中半徑最大(稀有氣體除外);E與C位于不同周期,E原子核外最外層電子數與C相同,其余各層電子均充滿.請根據以上信息,回答下列問題:(答題時A、B、C、D、E用所對應的元素符號表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增加.其中A與B、A與D在周期表中位置相鄰,A原子核外有兩個未成對電子,B元素的第一電離能比同周期相鄰兩個元素都大,C原子在同周期原子中半徑最大(稀有氣體除外);E與C位于不同周期,E原子核外最外層電子數與C相同,其余各層電子均充滿.請根據以上信息,回答下列問題:(答題時A、B、C、D、E用所對應的元素符號表示)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 )的說法中正確的是( )
)的說法中正確的是( )| A. | 分子組成符合通式CnH2n+2 | |
| B. | 分子中含有3個C-C鍵和3個C=C鍵 | |
| C. | 在空氣中燃燒時產生較多的黑煙 | |
| D. | 苯中加入溴水后溴水層顏色變淺,這是發生了加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com