解答:
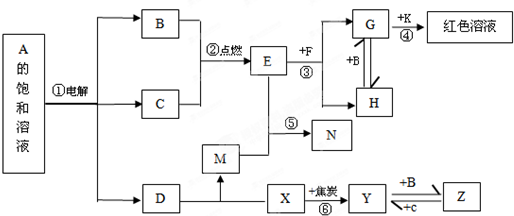
解:常溫下B、C為氣體單質,Y為固體單質,Y是電子工業中常用的半導體材料,則Y是Si元素;
F是具有磁性的黑色晶體,則F是Fe
3O
4;
E的水溶液與M混合后得到N,N經過干燥脫水可得到一種常用于實驗室和袋裝食品、瓶裝食品等的干燥劑,則N是硅酸,X和焦炭反應生成硅,則X是二氧化硅,二氧化硅和強堿反應生成鹽,電解A的飽和溶液生成強堿,同時生成兩種氣體,則A是氯化鈉,電解時生成氫氣、氯氣和氫氧化鈉,則D是氫氧化鈉;
氫氣和氯氣反應生成氯化氫,所以E是氯化氫;鹽酸和四氧化三鐵反應生成氯化鐵、氯化亞鐵,G和K反應生成紅色溶液,則G是氯化鐵,K是硫氰化鉀,G和B反應生成H,氯化亞鐵能被氯氣氧化,所以B是氯氣,C是氫氣,H是氯化亞鐵;硅和氯氣反應生成四氯化硅,所以Z是四氯化硅.
(1)通過以上分析知,反應①是電解飽和食鹽水,屬于氯堿工業,K是硫氰化鉀,其化學式為:KSCN,D是氫氧化鈉,氫氧化鈉中含有離子鍵和共價鍵,電子式為:

,故答案為:氯堿工業;KSCN;

;
(2)電解氯化鈉飽和溶液生成氯氣、氫氣和氫氧化鈉,離子反應方程式為:2Cl
-+2H
2O
H
2↑+Cl
2↑+2OH
-;
故答案為:2Cl
-+2H
2O
H
2↑+Cl
2↑+2OH
-;
(3)向H的水溶液中加入足量氨水并將溶液露置在空氣中,氯化亞鐵和氨水反應生成氫氧化亞鐵白色沉淀,氫氧化亞鐵不穩定,易被氧氣氧化生成紅棕色沉淀,所以看到的現象是:先有白色沉淀生成,后迅速變為灰綠色,最終變為紅褐色,向相同體積相同濃度的兩份G為FeCl
3溶液中分別滴加相同PH的氨水和D為NaOH溶液,當沉淀最大量時所加入的氨水和D溶液的體積分別為V
1、V
2,則V
1、V
2的大小關系V
1 <V
2故答案為:先有白色沉淀生成,后迅速變為灰綠色,最終變為紅褐色;<;
(4)⑥是二氧化硅和碳高溫反應,高溫下,二氧化硅和碳反應生成硅和一氧化碳,反應方程式為:SiO
2+2 C
Si+2CO↑;
故答案為:SiO
2+2 C
Si+2CO↑;
(5)N為硅酸,是酸性比碳酸還弱的酸,設計實驗證明,據化學反應遵循強酸制弱酸的原則,比較碳酸比硅酸強的反應應在水溶液中進行,二氧化碳和水反應生成碳酸,碳酸和可溶性硅酸鹽反應析出硅酸沉淀,說明碳酸能制取硅酸,所以能證明碳酸酸性強于硅酸酸性,
故答案為:二氧化碳和水反應生成碳酸,碳酸和可溶性硅酸鹽反應析出硅酸沉淀,說明碳酸能制取硅酸,所以能證明碳酸酸性強于硅酸酸性.

 ,故答案為:氯堿工業;KSCN;
,故答案為:氯堿工業;KSCN; ;
;

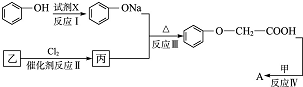
 發生酯化反應的產物A是一種食用香料.11.6g甲完全燃燒可產生0.6mol CO2和0.6mol H2O.相同條件下,甲蒸氣對氫氣的相對密度為29,甲分子為鏈狀結構且不含甲基.回答下列問題:
發生酯化反應的產物A是一種食用香料.11.6g甲完全燃燒可產生0.6mol CO2和0.6mol H2O.相同條件下,甲蒸氣對氫氣的相對密度為29,甲分子為鏈狀結構且不含甲基.回答下列問題: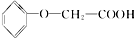 有多種同分異構體,其中屬于酯類,能使FeCl3溶液顯紫色,且苯環上的一氯代物有兩種的同分異構體的結構簡式為
有多種同分異構體,其中屬于酯類,能使FeCl3溶液顯紫色,且苯環上的一氯代物有兩種的同分異構體的結構簡式為