
【題目】硫酸銅晶體(CuSO4·![]() H2O藍色)在110℃開始失去結晶水,150℃失去全部結晶水,生成白色的無水硫酸銅。依據硫酸銅晶體受熱失去結晶水的事實,可以設計硫酸銅晶體水含量
H2O藍色)在110℃開始失去結晶水,150℃失去全部結晶水,生成白色的無水硫酸銅。依據硫酸銅晶體受熱失去結晶水的事實,可以設計硫酸銅晶體水含量![]() 的測定方法。請根據以下實驗數據回答相關問題:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的測定方法。請根據以下實驗數據回答相關問題:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩堝質量 | 坩堝和晶體的質量 | 完全失去結晶水后坩堝和剩余固體的質量 |
11.685g | 13.691g | 12.948g |
(1)要完成此實驗,至少要稱量______次。
(2)![]() ______(保留2位小數),本次實驗結果____(填“偏高”、“偏低”)。
______(保留2位小數),本次實驗結果____(填“偏高”、“偏低”)。
(3)造成本次誤差可能的原因是______。
A. 加熱時有晶體濺出
B. 實驗前坩堝內有受熱不揮發、不分解也不與硫酸銅反應的雜質
C. 粉末未完全變白就停止加熱
D. 加熱后放在空氣中冷卻
(4)請寫出造成本次誤差還有可能存在的其他原因(寫出其中一點)_____________________。
(5)如果硫酸銅晶體樣品不純,測定結果________。
A.沒有偏差 B. 一定偏小 C. 一定偏大 D. 無法確定
【答案】4 5.21 偏高 A 加熱時間過程,晶體部分變黑 D
【解析】
在CuSO4晶體結晶水測定的實驗中至少4次稱量;
根據結晶水合物中,結晶水的質量=m(硫酸銅晶體)m(無水硫酸銅),依據化學方程式可以計算結晶水的值;
實驗誤差=![]() ×100%;
×100%;
坩堝濕、晶體濺出、硫酸銅分解都會導致加熱前后固體的質量差偏大;
硫酸銅晶體樣品不純,可能含有易揮發的雜質,也可能含有不易揮發的雜質,據此分析。
(1)在CuSO4晶體結晶水測定的實驗中至少4次稱量,分別為:坩堝質量、坩堝和樣品質量、灼燒后坩堝和樣品質量、再灼燒后坩堝和樣品質量,
故答案為:4;
(2)硫酸銅晶體的質量為13.691g-11.685g=2.006g,硫酸銅的質量為12.948-11.685=1.263g,所以結晶水的質量為2.006-1.263=0.743g;
CuSO4![]() xH2O= CuSO4
xH2O= CuSO4![]() +xH2O
+xH2O
159.5 18x
1.263g 0.743g
![]() =
=![]() ,解得x≈5.21;
,解得x≈5.21;
實驗誤差=![]() ×100%=4.20%,誤差為正值,即偏高;
×100%=4.20%,誤差為正值,即偏高;
故答案為:5.21;偏高;
(3) A.加熱過程中晶體有少量濺失,造成加熱前后固體的質量差偏大,測定結果偏高;
B. 實驗前坩堝內有受熱不揮發、不分解也不與硫酸銅反應的雜質,只有其中的硫酸銅晶體分解,造成加熱前后固體的質量差偏小,使測定結果偏低;
C. 粉末未完全變白就停止加熱,造成加熱前后固體的質量差偏小,使測定結果偏低;
D. 加熱后放在空氣中冷卻,吸收空氣中的水分,造成加熱前后固體的質量差偏小,使測定結果偏低。
故答案選:A;
(4) 加熱時間過程,晶體部分變黑,也會造成加熱前后固體的質量差偏大,測定結果偏高;
故答案為:加熱時間過程,晶體部分變黑;
(5)如果硫酸銅晶體樣品不純,可能有兩種情況:一是硫酸銅晶體樣品中含有易揮發雜質,造成加熱前后固體的質量差偏大,使測定結果偏高;二是硫酸銅晶體樣品中含有細沙等不易揮發雜質,加熱后不揮發性雜質不分解,只有其中的硫酸銅晶體分解,造成加熱前后固體的質量差偏小,使測定結果偏低,所以無法確定,故選D。
故答案選:D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】某興趣小組設計如下微型實驗裝置。實驗時,發現斷開K2,閉合K1,兩極均有氣泡產生;一段時間后,斷開K1,閉合K2,發現電流表指針偏轉,下列有關描述正確的是
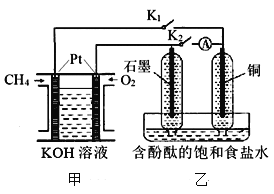
A. 斷開K2,閉合K1時,石墨電極上的電極反應式為:2 H++ 2e-=H2↑
B. 斷開K1,閉合K2時,銅電極上的電極反應式為:Cl2 + 2e-=2Cl-
C. 甲裝置屬于燃料電池,該電池正極的電極反應式為:CH4+10OH--8e-=CO32-+7H2O
D. 甲烷燃料電池的總電極反應式為:CH4+2O2 +2NaOH=Na2CO3+3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是( )
A.鐵表面鍍銅時,鐵與電源的正極相連,銅與電源的負極相連
B.將1 mol Cl2通入水中,HClO、Cl-、ClO-粒子數之和為2×6.02×1023
C.常溫下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自發進行,則該反應的ΔH>0
CO(g)+H2(g)不能自發進行,則該反應的ΔH>0
D.保持溫度不變,向稀氨水中緩慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蘊藏在海底的大量“可燃冰”,其開發利用是當前解決能源危機的重要課題。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
化學鍵 | C—H | H—H | H—O |
鍵能kJ/mol | b | c | d |
(1)寫出甲烷的結構式___________
(2)C=O的鍵能為_______________kJ/mol (用含a、b、c、d的式子表示)
(3)恒溫條件下,在體積恒為0.5L的密閉容器中通入一定量甲烷和水蒸氣,發生上述反應。測得甲烷物質的量隨時間變化如下表所示。0~10min內用H2O的濃度表示該反應的平均速率為ν(H2O)= _____________
時間/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒溫恒容情況下,下列敘述能說明此反應達到平衡狀態的是_______________。
a.混合氣體的平均相對分子質量保持不變 b.CO2和H2的體積分數比為1﹕4
c.混合氣體的密度保持不變 d.1mol CO2生成的同時有4mol H-H鍵斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C物質為烴類,在標準狀況下的密度為1.16g/L,F物質具有水果香味,G物質不能水解。轉化關系如圖所示,省略了反應條件。

請回答下列問題:
(1)寫出G的分子式:____________________。
(2)D中官能團的名稱是__________________________。 C→A的反應類型____________
(3)請寫出反應B+E→F的化學方程式:______________________。
(4)下列有關說法正確的是_____________________________。
A.C物質燃燒時,易產生大量黑煙 B.物質B和甘油( )互為同系物
)互為同系物
C.一定條件下,A可被直接氧化為D D.用NaOH溶液可以區分B、D、F
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答下列問題:

(1)寫出③、⑤兩種元素形成的化合物有兩種,電子式分別是:__,___。
(2)寫出①元素形成最簡單有機物是__,它和氯氣反應的一個方程式__。
(3)這些元素的最高價氧化物的對應水化物中__酸性最強;__堿性最強;能形成兩性氫氧化物的元素是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是元素周期表發表150周年,期間科學家為完善周期表做出了不懈努力。2017年5月9日,中國公布113號、115號、117號和118號四種元素的中文名稱。其中118號元素的原子符號為![]() Og,中文名稱為“
Og,中文名稱為“![]() ”下列說法不正確的是
”下列說法不正確的是
A. 質子數為118B. 中子數為176
C. 核外電子數為118D. 質量數為412
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】線型PAA(![]() )具有高吸水性,網狀PAA在抗壓性、吸水性等方面優于線型PAA。網狀PAA的制備方法是:將丙烯酸用NaOH中和,加入少量交聯劑a,再引發聚合。其部分結構片段如下:
)具有高吸水性,網狀PAA在抗壓性、吸水性等方面優于線型PAA。網狀PAA的制備方法是:將丙烯酸用NaOH中和,加入少量交聯劑a,再引發聚合。其部分結構片段如下:
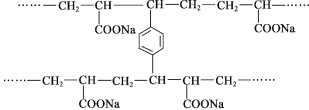
下列說法不正確的是( )
A. 線型PAA的單體不存在順反異構現象
B. 交聯劑a的結構簡式是![]()
C. 形成網狀結構的過程發生了加聚反應
D. PAA的高吸水性與—COONa有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列說法正確的是( )
2AB2(g) ΔH<0,下列說法正確的是( )
A. 達到平衡后,升高溫度有利于該反應平衡正向移動
B. 達到化學平衡時,v正(A2)=2v逆(B2)
C. 升高溫度,正向反應速率增加,逆向反應速率減小
D. 達到平衡后,降低溫度A2氣體的轉化率增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com