
【題目】(1)某一反應體系中的物質有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反應物之一。
①寫出配平的該反應的化學方程式:_______________
②被氧化的元素是___________
(2)氫化亞銅(CuH)是一種難溶物質,用CuSO4溶液和“另一物質”在40~50℃時反應可生成它.CuH具有的性質有:不穩定,易分解;在氯氣中能燃燒;與稀鹽酸反應能生成氣體;Cu+在酸性條件下發生的反應是:2Cu+==Cu2++Cu.
根據以上信息,結合自己所掌握的化學知識,回答下列問題:
①寫出CuH在氯氣中燃燒的化學反應方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的氣體只有NO,請寫出CuH溶解在足量稀硝酸中反應的離子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃燒生成CO2和液態水時放熱22.68kJ。則表示甲醇燃燒熱的熱化學方程式為_________
【答案】12HCl + 3SnCl2 + 2H3AsO3 = 3 H2SnCl6 +2 As + 6H2O Sn 2CuH+3Cl2![]() 2CuCl2+2HCl CuH+3H++NO3-===Cu2++2H2O+NO↑ CH3OH(l)+3/2O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
2CuCl2+2HCl CuH+3H++NO3-===Cu2++2H2O+NO↑ CH3OH(l)+3/2O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
【解析】
本題考查的是銅金屬及其重要化合物的主要性質、化學方程式的書寫、氧化還原反應、熱化學反應方程式的書寫。
(1)HCl是反應物之一,根據氫元素、氯元素的價態,可知HCl在反應中起酸的作用,HCl中氫元素生成水,由元素守恒知H3AsO3是反應物,根據As、Sn元素化合價及電子轉移守恒可知, H3AsO3是氧化劑,被還原為As,SnCl2是還原劑,被氧化為H2SnCl6,再根據質量守恒、電子轉移守恒書寫方程式;
(2)氧化劑得電子被還原,所含元素化合價降低,化合價升高的元素被氧化;
(3)CuH在氯氣中燃燒,氯氣做氧化劑,CuH做還原劑;
(4)Cu+在酸性條件下發生的反應是:2Cu+=Cu2++Cu,稀硝酸具有強氧化性,能和銅反應生成一氧化氮氣體;
(5)燃燒熱是1mol可燃物完全燃燒生成穩定氧化物時放出的熱量。
(1)①HCl是反應物之一,根據氫元素、氯元素的價態,可知HCl在反應中起酸的作用,HCl中氫元素生成水,由元素守恒知H3AsO3是反應物,根據As、Sn元素化合價及電子轉移守恒可知,H3AsO3是氧化劑,被還原為As,SnCl2是還原劑,被氧化為H2SnCl6,所以反應方程式為12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O。本小題答案為:12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O。
②根據①的分析可知H3AsO3是氧化劑,被還原為As,SnCl2是還原劑,被氧化為H2SnCl6,則被氧化的元素是Sn。本小題答案為:Sn。
(2)①CuH在氯氣中燃燒,氯氣做氧化劑,CuH做還原劑,所以反應方程式為:2CuH+3Cl2![]() 2CuCl2+2HCl。本小題答案為:2CuH+3Cl2
2CuCl2+2HCl。本小題答案為:2CuH+3Cl2![]() 2CuCl2+2HCl。
2CuCl2+2HCl。
②Cu+在酸性條件下發生的反應是:2Cu+=Cu2++Cu,稀硝酸具有強氧化性,CuH具有還原性,二者反應生成一氧化氮氣體、銅離子、H2O。本小題答案為:CuH+3H++NO3-=Cu2++2H2O+NO↑;
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃燒生成CO2和液態水時放熱22.68kJ,則32g甲醇燃燒生成CO2和液態水時放熱22.68kJ×32=725.76kJ,1mol甲醇質量為32g,所以完全燃燒1mol甲醇生成二氧化碳和液態水放熱725.76kJ,甲醇燃燒熱的熱化學方程式為:CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l)△H=725.76kJmol1。本小題答案為:CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l)△H=725.76kJmol1。


科目:高中化學 來源: 題型:
【題目】某學生用如圖所示裝置制取氯氣,并收集氯氣進行實驗。
請完成下列問題:
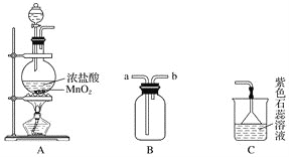
(1)裝置A中發生反應的離子方程式為______________________________________。
(2)裝置B如圖中所示正放,則連接A的接口是________(填序號)。
(3)實驗中可觀察到裝置C中紫色石蕊溶液的現象是__________________,其原因______________________________________________________________________。
(4)取出B中的集氣瓶進行氯氣與銅的反應實驗,應該進行的操作是______________,然后立刻放入充滿氯氣的集氣瓶中。實驗中有同學提出應該在集氣瓶底先放少量的水或細沙,你認為__________(填“需要”或“不需要”)放,理由是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組要完成中和熱的測定。
(1)實驗桌上備有大、小兩個燒杯、量筒、泡沫塑料、泡沫塑料板、膠頭滴管、0.5 mol·L-1鹽酸、0.55 mol·L-1NaOH溶液,實驗尚缺少的玻璃用品是______、_______________。他們記錄的實驗數據如下:
實驗用品 | 溶液溫度 | 中和熱 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反應后溶液的比熱容c為4.18 kJ·℃-1·kg-1,各物質的密度均為1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根據實驗結果寫出NaOH溶液與HCl溶液反應的熱化學方程式: ___________________。
(4)若用KOH代替NaOH,對測定結果________(填“有”或 “無”)影響;若用醋酸代替HCl做實驗,對測定結果__________(填“有”或“無”)影響。
(5)兩溶液混合后,怎樣攪拌溶液_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把A、B、C、D四塊金屬片浸入稀硫酸中,分別用導線兩兩相連可以組成原電池。A、B相連時A為負極;C、D相連時,電流由D→C;A、C相連時,C極上產生大量氣泡,B、D相連時,D極發生氧化反應。這四種金屬的活動性順序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如何降低大氣中![]() 的含量及有效地開發利用
的含量及有效地開發利用![]() 引起了全世界的普遍重視。目前工業上有一種方法是用
引起了全世界的普遍重視。目前工業上有一種方法是用![]() 來生產燃料甲醇。為探究該反應原理,進行如下實驗:在容積為1L的密閉容器中,充入
來生產燃料甲醇。為探究該反應原理,進行如下實驗:在容積為1L的密閉容器中,充入![]() 和
和![]() ,在
,在![]() 下發生發應,
下發生發應,![]() 實驗測得
實驗測得![]() 和
和![]() 的物質的量濃度隨時間變化如下所示:
的物質的量濃度隨時間變化如下所示:
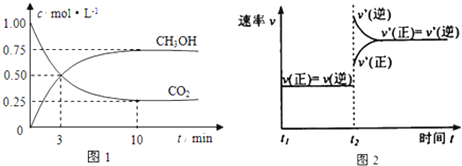
(1)從反應開始到平衡,氫氣的平均反應速率![]() ______。500℃達平衡時,
______。500℃達平衡時,![]() 的體積分數為______,如上圖是改變某條件時化學反應速率隨時間變化的示意圖,則該條件是______ 該反應的逆反應為______反應
的體積分數為______,如上圖是改變某條件時化學反應速率隨時間變化的示意圖,則該條件是______ 該反應的逆反應為______反應![]() 填“放熱”或“吸熱”
填“放熱”或“吸熱”![]()
(2)500℃該反應的平衡常數為______![]() 保留兩位小數
保留兩位小數![]() ,若降低溫度到300℃進行,達平衡時,K值______
,若降低溫度到300℃進行,達平衡時,K值______![]() 填“增大”“減小”或“不變”
填“增大”“減小”或“不變”![]() .
.
(3)下列措施中能使![]() 的轉化率增大的是______.
的轉化率增大的是______.
A. 在原容器中再充入![]()
B. 在原容器中再充入![]() 和
和![]()
C. 在原容器中充入![]()
![]() 使用更有效的催化劑
使用更有效的催化劑
E. 將水蒸氣從體系中分離出
(4)500℃條件下,改變起始反應物的用量,測得某時刻![]() 、
、![]() 、
、![]() 和
和![]() 的濃度均為
的濃度均為![]() ,則此時
,則此時![]() 正
正![]() ______
______![]() 逆
逆![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(5)假定該反應是在恒容恒溫條件下進行,判斷該反應達到平衡的標志______.
A. 消耗![]() 同時生成1mol
同時生成1mol![]()
![]() 混合氣體密度不變
混合氣體密度不變
C. 混合氣體平均相對分子質量不變
D.3v正(H2)=v逆(H2O)
E.![]() .不變
.不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“長征二號”系列火箭用的燃料是液態的偏二甲肼(C2H8N2),氧化劑是液態的N2O4,已知已知1.5g偏二甲基肼完全燃燒生成N2、CO2和液態H2O放出熱量50kJ熱量。下列說法不正確的是
A. 燃料在火箭發動機中燃燒是將化學能主要轉變為熱能和機械能
B. 液態N2O4氣化時共價鍵沒被破壞
C. 依題可知C2H8N2的燃燒熱為50kJ/mol
D. 偏二甲基肼在N2O4中燃燒時的化學方程式為:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗事故的處理方式不恰當的是
A. 實驗時手不慎被玻璃劃傷,先取出傷口中的碎玻璃片再用雙氧水清洗,然后敷藥包扎
B. 酒精燈著火了用濕毛巾蓋滅
C. 將CO中毒者移至通風處搶救
D. 不慎將NaOH溶液粘在皮膚上,先用大量水沖洗,再涂上鹽酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com