
【題目】扁桃酸衍生物是重要的醫藥中間體,以物質a為原料合成扁桃酸衍生物b的過程如下:下列說法正確的是( )
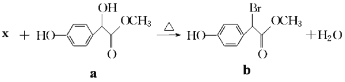
A.物質X是Br2, 物質a轉化為b屬于取代反應
B.lmol物質a能與3molH2反應,且能在濃硫酸中發生消去反應
C.物質b具有多種能與NaHCO3反應的同分異構體
D.物質b的核磁共振氫譜有四組峰
 精英口算卡系列答案
精英口算卡系列答案 應用題點撥系列答案
應用題點撥系列答案科目:高中化學 來源: 題型:
【題目】二氧化氯是高效、低毒的消毒劑。已知:ClO2 是一種黃綠色易溶于水的氣體,具有強氧化性, 回答下列問題:
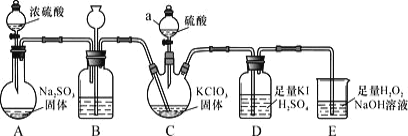
(1)ClO2 的制備及性質探究(如圖所示)
①儀器 C 的名稱為_________,裝置 B 的作用是________。
②裝置C 用于制備ClO2,同時還生成一種酸式鹽,該反應的化學方程式為_____,裝置 D 中滴有幾滴淀粉溶液,其作用是_______。
③裝置E 用于吸收尾氣,反應生成NaClO2,則該反應中氧化劑與還原劑的物質的量之比為___,氧化產物是___。
(2)粗略測定生成 ClO2 的量實驗步驟如下:
a、取下裝置 D,將其中的溶液轉入 250mL 容量瓶,用蒸餾水洗滌 D 瓶 2~3 次,并將洗滌液一并轉移到容量瓶中,再用蒸餾水稀釋至刻度。
b、從容量瓶中取出 25.00mL 溶液于錐形瓶中,用 0.1000mol/L 硫代硫酸鈉標準溶液滴定(I2+2S2O32-=2I-+S4O62-),指示劑顯示終點時共用去 24.00 mL 硫代硫酸鈉溶液。
①滴定至終點的現象是___。
②進入裝置 D 中的 ClO2 質量為___,與 C 中 ClO2 的理論產量相比,測定值偏低, 可能的原因是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,當加入AgNO3溶液后,溶液顏色變淺
HCl+HClO,當加入AgNO3溶液后,溶液顏色變淺
B.對CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡體系增大壓強可使顏色變深
CO2(g)+NO(g),平衡體系增大壓強可使顏色變深
C.對2NO2(g)![]() N2O4(g), 升高溫度平衡體系顏色變深
N2O4(g), 升高溫度平衡體系顏色變深
D.SO2催化氧化成SO3的反應,往往加入過量的空氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國研究人員研制出一種新型復合光催化劑,利用太陽光在催化劑表面實現高效分解水,其主要過程如下圖所示。

已知:幾種物質中化學鍵的鍵能如下表所示。
化學鍵 | H2O中H—O鍵 | O2中O=O 鍵 | H2中H—H鍵 | H2O2中O—O鍵 | H2O2中O—H鍵 |
鍵能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反應過程中分解了2 mol水,則下列說法不正確的是
A. 總反應為2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 過程I吸收了926 kJ能量
C. 過程II放出了574 kJ能量
D. 過程Ⅲ屬于放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用電解質溶液的濃度對電極電勢的影響,可設計濃差電池。下圖為一套濃差電池和電解質溶液再生的配套裝置示意圖,閉合開關K之前,兩個Cu電極的質量相等。下列有關這套裝置的說法中錯誤的是

A. 循環物質E為水
B. 乙池中Cu電極為陰極,發生還原反應
C. 甲池中的電極反應式為Cu2++2e-=Cu
D. 若外電路中通過1mol電子,兩電極的質量差為64g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q、R 是周期表中前 36 號元素,核電荷數依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 為非金屬元素,且 X 原子的核外成對電子數是未成對電子數的 2 倍,Z 的次外層電子數是最外層電子數的![]() ,W 原子的 s 電子與 p 電子數相等,Q 是前四周期中電負性最小的元素,R 的原子序數為 29。 回答下列問題:
,W 原子的 s 電子與 p 電子數相等,Q 是前四周期中電負性最小的元素,R 的原子序數為 29。 回答下列問題:
(1)X的最高價氧化物對應的水化物分子中,中心原子采取______________雜化。
(2)化合物 XZ 與 Y 的單質分子互為______________,1mol XZ 中含有π鍵的數目為______________。
(3)W 的穩定離子核外有______________種運動狀態的電子。W元素的第一電離能比其同周期 相鄰元素的第一電離能高,其原因是:_____。
(4)Q 的晶體結構如圖所示,則在單位晶胞中 Q 原子的個數為______________,晶體的配位數是______________。

(5)R元素的基態原子的核外電子排布式為________;Y 與 R 形成某 種化合物的晶胞結構如圖所示,已知該晶體的密度為ρg·cm-3,阿伏加德羅常數的數值為 NA,則該晶體中 R 原子和 Y 原子之間的最短距離為______________cm。(只寫計算式)
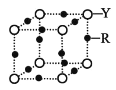
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釩及其化合物在工業上有許多用途。某釩精礦的主要成分及質量分數如下表:
物質 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
質量分數% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一種從該釩精礦中提取五氧化二釩的流程如下:
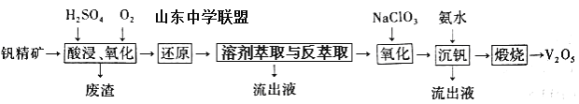
回答下列問題:
(1)“酸浸、氧化”時,V2O3轉化為VO2+,反應的離子方程式為____________________________________;若用濃鹽酸代替硫酸,V2O5轉化為VO2+,同時生成有毒的黃綠色氣體,反應的化學方程式為__________________。
(2)萃取劑對四價釩具有高選擇性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名稱,下同)對浸出液進行“還原”處理。為檢驗“還原”后的濾液中是否含有Fe3+,可選用的化學試劑是____________________。
(3)“溶劑萃取與反萃取”可表示為:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)為萃取劑,為了提高VO2+的產率,反萃取劑應該呈 __________性(填“酸”“堿”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)為萃取劑,為了提高VO2+的產率,反萃取劑應該呈 __________性(填“酸”“堿”或“中”)。
(4)“氧化”中,欲使3molVO2+變為VO2+,則需要氧化劑NaClO3至少為____________mol。
(5)單質釩可用于制造特種合金鋼。以五氧化二釩和金屬鈣為原料在高溫條件下可制備單質釩,表示制備過程的化學方程式為________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用煤油作溶劑,二(2-乙基己基)磷酸酯作流動載體,H2SO4 作內相酸處理含銅廢水。 在其他條件相同時,Cu2+萃取率[萃取率= ×100% ]與初始 Cu2+濃度關系如圖 1 所示;在其他條件相同時,處理前初始 Cu2+濃度為 200 mg·L-1,Cu2+萃取率與廢水 pH 的關系如圖 2 所示。下列說法錯誤的是
×100% ]與初始 Cu2+濃度關系如圖 1 所示;在其他條件相同時,處理前初始 Cu2+濃度為 200 mg·L-1,Cu2+萃取率與廢水 pH 的關系如圖 2 所示。下列說法錯誤的是
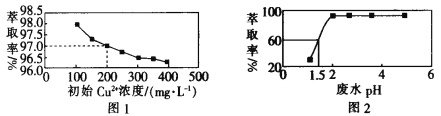
A.根據圖 1 可知,廢水中初始 Cu2+濃度越大,Cu2+的萃取效果越好
B.根據圖 2 可知,廢水初始 pH>2 時,去除 Cu2+的效果較好
C.根據圖 1 可知,Cu2+初始濃度為 200 mg·L-1 時,Cu2+的萃取率為 97.0%
D.根據圖 2 可知,若取 800 mL 初始 Cu2+濃度為 200 mg·L-1 的廢水,在 pH=1.5 時處理廢水,則處理后的廢水中剩余 Cu2+的物質的量為 1.5×10-3mol(假設體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2和氮氧化物的轉化和綜合利用既有利于節約資源,又有利于保護環境。
(1)H2還原法是處理燃煤煙氣中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)=H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)=H2O(g) ΔH=c kJ·mol—1
寫出SO2(g)和H2(g)反應生成S(s)和H2O(g)的熱化學方程式:____________。
(2)SO2經過凈化后與空氣混合進行催化氧化可制取硫酸,其中SO2發生催化氧化的反應為:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa條件下,往一密閉容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],測得容器內總壓強與反應時間如圖所示。
2SO3(g)。若在T1℃、0.1 MPa條件下,往一密閉容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],測得容器內總壓強與反應時間如圖所示。

①圖中A點時,SO2的轉化率為____________。
②在其他條件不變的情況下,測得T2℃時壓強的變化曲線如圖所示,則C點的正反應速率vc(正)與A點的逆反應速率vA(逆)的大小關系為vc(正)______vA(逆)(填“>”、“<”或“=”)。
③圖中B點的壓強平衡常數Kp=_______________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)利用脫氮菌可凈化低濃度NO廢氣。當廢氣在塔內停留時間均為90s的情況下,測得不同條件下NO的脫氮率如圖Ⅰ、Ⅱ所示。

①由圖I知,當廢氣中的NO含量增加時,宜選用_________法提高脫氮效率。
②圖Ⅱ中,循環吸收液加入Fe2+、Mn2+提高了脫氮的效率,其可能原因為____________。
⑷研究表明:NaClO2/H2O2酸性復合吸收劑可同時有效脫硫、脫硝。圖Ⅲ所示為復合吸收劑組成一定時,溫度對脫硫脫硝的影響。
①寫出廢氣中的SO2與NaClO2反應的離子方程式:____________________________。
②溫度高于60℃后,NO去除率隨溫度升高而下降的原因為_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com