
【題目】I. 如圖所示,U形管的左端被水和膠塞封閉有甲烷和氯氣(體積比為1:4)的混合氣體,假定氯氣在水中的溶解度可以忽略,將封閉有甲烷和氯氣的混合氣體的裝置放置在有光的地方,讓混合氣體緩慢地反應一段時間。

(1)假設甲烷與氯氣(體積比為1:4)反應充分,且只產生一種有機物,請寫出化學方程式____________________________________。
(2)經過幾個小時的反應后,U形管右端的玻璃管中水柱變化是______(填字母序號)
A.升高 B.降低 C.不變 D.無法確定
II .在實驗室里制取乙烯的反應為:![]() 。常因溫度控制不當而發生副反應,有人設計如圖實驗以確認上述混合氣體中有乙烯和二氧化硫。
。常因溫度控制不當而發生副反應,有人設計如圖實驗以確認上述混合氣體中有乙烯和二氧化硫。

(3)乙烯使溴水褪色的化學方程式:______________________________。
(4)I 、II、III、Ⅳ裝置可盛放的試劑是(填下列字母代號):
I ______; II ______; III ______; Ⅳ ______。
A.品紅溶液B.NaOH溶液C.濃H2SO4 D.溴水
(5)確認含有乙烯的現象是 _________________________________。
【答案】![]() B
B![]() ABAD裝置III中溶液不褪色,裝置IV中溶液褪色
ABAD裝置III中溶液不褪色,裝置IV中溶液褪色
【解析】
甲烷和氯氣在光照的條件下可以發生取代反應,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氫,一氯甲烷和氯化氫是氣體,氯代烷不溶于水,氯化氫極易溶于水。要證明氣體中有乙烯和二氧化硫,應先根據二氧化硫的漂白性檢驗二氧化硫,然后用氫氧化鈉溶液除去二氧化硫后再用溴水檢驗乙烯。
I.(1)假設甲烷與氯氣(體積比為1:4)反應充分,且只產生一種有機物,則反應產物為四氯化碳和氯化氫,該反應的化學方程式為![]() 。
。
(2)經過幾個小時的反應后,因氯化氫溶于水及生成液態產物導致左側氣壓弱小,故U形管右端的玻璃管中水柱下降,選B 。
II .(3)乙烯使溴水褪色的化學方程式:![]() 。
。
(4)由實驗目的可知,I用于檢驗二氧化硫,通常用品紅溶液;II用于吸收二氧化硫,通常用NaOH溶液;III用于檢驗二氧硫是否除盡,用品紅溶液;IV用于檢驗乙烯,用溴水。所以I、II、III、IV裝置可盛放的試劑是A、B、A、D.
(5)確認含有乙烯的現象是:裝置III中溶液不褪色,裝置IV中溶液褪色。


科目:高中化學 來源: 題型:
【題目】已知W、X、Y、Z為短周期元素,W、Z同主族,X、Y、Z同周期,W的氣態氫化物的穩定性大于Z的氣態氫化物穩定性,X、Y為金屬元素,X的陽離子的氧化性小于Y的陽離子的氧化性,下列說法正確的是
A. X、Y、Z、W的原子半徑依次減小
B. W與X形成的化合物中只含離子鍵
C. W的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點
D. 若W與Y的原子序數相差5,則二者形成化合物的化學式一定為Y2W3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填空.
(1)如圖1是常見儀器的部分結構.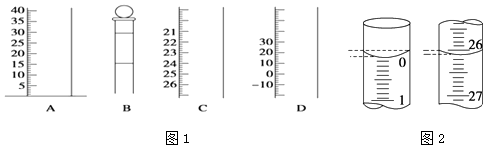
①寫出儀器名稱BC
②使用前需檢查是否漏水的儀器有 .
(2)用標準的鹽酸滴定待測的NaOH溶液時,左手握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視 . 滴定終點時,錐形瓶中顏色變化為 , 且半分鐘內顏色不復原.
(3)下列操作中可能使所測NaOH溶液的濃度數值偏低的是
A.酸式滴定管未用標準鹽酸潤洗就直接注入標準鹽酸
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(4)若滴定開始和結束時,酸式滴定管中的液面如圖2所示,所用鹽酸溶液的體積為mL.
(5)某學生根據3次實驗分別記錄有關數據如表:
滴定 | 待測NaOH溶液的體積/mL | 0.100 0mol/L鹽酸的體積/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依據表數據列式計算該NaOH溶液的物質的量濃度 . (保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閱讀、分析下列兩個材料:
材料一:如圖
材料二:如表
物質 | 熔點/℃ | 沸點/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根據上述材料及課本知識,回答下列問題(每空只填一個字母選項,):
A.蒸餾法 B.萃取法 C.“溶解、結晶、過濾”的方法 D.分液法
(1)分離汽油和水的最佳方法是;
(2)去除純堿中的少量氯化鈉雜質,最好應用;
(3)將乙二醇和丙三醇相互分離的最佳方法是 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有色金屬行業發展蘊藏著巨大潛力。目前,全世界消費量排在前五位的為銅、鋁、鉛、鋅、鎳。回答下列問題。
(1)銅原子的電子占有________種能量不同的原子軌道;在元素周期表中鋁和鉛元素處于周期表的_____區。
(2)配合物分子內(如圖)的化學鍵有____________(填序號)。

A.氫鍵 B.離子鍵 C.共價鍵 D.金屬鍵 E.配位鍵
(3)很多不飽和有機物在Ni催化下可以與H2發生加成反應。如①CH2=CH2、②CH![]() CH、③苯、④HCHO等,其中分子中C原子為sp雜化的有___________(填物質序號);預測σ鍵與π鍵比值為3∶1的分子的立體結構為_______________形。
CH、③苯、④HCHO等,其中分子中C原子為sp雜化的有___________(填物質序號);預測σ鍵與π鍵比值為3∶1的分子的立體結構為_______________形。
(4)硫酸鋅是最重要的鋅鹽,為無色斜方晶體或白色粉末,其七水合物(ZnSO4·7H2O) 俗稱皓礬,是一種天然礦物。請在SO42-的立體結構圖(如圖)中,描畫出氧原子(用實心圓點“![]() ”表示)和硫原子(用空心圓點“O”表示)的位置。_____________
”表示)和硫原子(用空心圓點“O”表示)的位置。_____________

(5)氫氣是新型清潔能源,鑭(La)和鎳(Ni)的合金可做儲氫材料。
①下列關于該貯氫材料及氫氣的說法,正確的是__________(填序號)。
A.該材料中鑭原子和鎳原子之間存在化學鍵,是原子晶體
B.已知鑭和鎳的第一電離能分別為5.58eV、7.64eV,可見氣態鑭原子比氣態鎳原子更容易變成+1價的氣態陽離子
C.氫分子被吸收時首先要在合金表面解離變成氫原子,同時放出熱量
D.該材料貯氫時采用常溫高壓比采用常溫常壓更好
E.氫氣很難液化是因為雖然其分子內氫鍵很強,但其分子間作用力很弱
②該合金的晶胞如圖所示,屬六方晶系,底面夾角為60°(120°),經測定晶胞參數a=511pm,c=397pm,晶胞中心有一個鎳原子,其他鎳原子都在晶胞面上,鑭原子都在晶胞頂點上,該晶體的化學式為_______________。若每個晶胞可吸收3個H2,則儲氫后(氫進入晶胞空隙,體積不變)該晶胞的密度計算式為___________________________。(NA表示阿伏加德羅常數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]X、Y、Z、W、R五種短周期非金屬元素原子序數依次增大,X、Y、Z、W為同周期元素且未成對電子數之比為1:2:3:2,R和Z同主族。請回答下列問題:
(1)Z的基態原子的價層電子排布圖為______________________________。
(2)Z、W、R 三種元素的電負性由大到小的順序為_____________(用元素符號表示)。
(3)W的常見氫化物的氫鍵的鍵能小于HF氫鍵的鍵能,但W的常見氫化物常溫下為液態而HF常溫下為氣態的原因是_______________________________。
(4)某種分子式為Y4Z4W8的物質(該物質中同種原子的化學環境完全相同,不含碳碳雙鍵)是一種威力極強的炸藥,則可推知其結構簡式為_________________________。
(5)XR是一種耐磨材料,可由X的三溴化物和R的三溴化物于高溫下在氧氣的氛圍中合成。
①X的三溴化物分子中X原子的雜化方式為_______________,R的三溴化物分子的空間構型的名稱為_____________________。
②合成XR的化學方程式為_____________________。
(6)Y與W形成的某種常見化合物的晶胞如圖, 該晶體中分子的配位數為__________________,若晶胞的棱長為a nm,阿伏加德羅常數的值為NA,晶體的密度為______g/cm3。
該晶體中分子的配位數為__________________,若晶胞的棱長為a nm,阿伏加德羅常數的值為NA,晶體的密度為______g/cm3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com