
【題目】在一定條件下,PbO2 與Cr3+反應,產物是Cr2O72-和Pb2+,則與5molCr3+反應所需PbO2的物質的量為
A. 7.5mol B. 1.5mol C. 3mol D. 3.25mol
 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:
【題目】文房四寶即筆、墨、紙、硯,其中以湖筆、徽墨、宣紙和端硯最為稱著。下列說法正確的是
A.徽墨中墨的主要成分是黑色的油脂B.湖筆中筆頭的羊毫的主要成分是蛋白質
C.宣紙的主要成分是無機碳和少量的纖維素D.含較多氧化鐵的端硯呈黑色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為探究元素周期表中元素性質的遞變規律,設計了如下實驗。
Ⅰ.(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:________與鹽酸反應最劇烈,________與鹽酸反應的速度最慢;________與鹽酸反應產生的氣體最多。
向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為_______________。
(3)資料顯示:鈉、鎂、鋁都可以用于制備儲氫的金屬氫化物。
① NaH是離子化合物,能與水發生氧化還原反應生成H2,該反應的還原劑是________________。
② NaAlH4是一種良好的儲氫材料。NaAlH4與水反應產生氫氣的化學方程式為____________________。
Ⅱ.為驗證氯、溴、碘三種元素的非金屬性強弱,用下圖所示裝置進行試驗(夾持儀器已略去,氣密性已檢驗)。
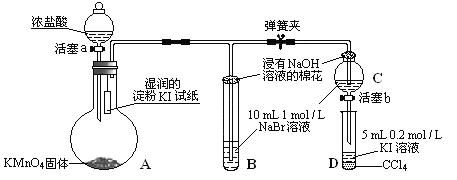
實驗過程:
①打開彈簧夾,打開活塞a,滴加濃鹽酸。
②當B和C中的溶液都變為黃色時,夾緊彈簧夾。
③當B中溶液由黃色變為棕紅色時,關閉活塞a。
④……
(1)A中發生反應生成氯氣,請寫出該反應的離子方程式:___________________。
(2)驗證氯氣的氧化性強于碘的實驗現象是________________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________。
(4)為驗證溴的氧化性強于碘,過程④的操作和現象是______________________。
(5)過程③實驗的目的是____________________。
(6)請運用原子結構理論解釋氯、溴、碘非金屬性逐漸減弱的原因:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表一部分,列出了十個元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
請用化學用語回答下列問題
(1)在①~⑦元素中,原子半徑最大的是 (填元素符號);
(2)①~⑩中元素最高價氧化物對應的水化物中酸性最強的是 (填物質化學式),⑤所對應元素的單質工業制備方法為 。
(3)用電子式表示元素③與⑧形成化合物的過程 。
(4)我國首創以單質⑤—空氣—海水電池作為能源的新型的海水標志燈,以海水為電解質溶液,靠空氣中的氧氣使單質⑤不斷氧化而產生電流,只要把燈放入海水數分鐘,就會發出耀眼的白光。則電源的負極反應是 ,正極反應為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】簡答題:
(1)NH4Cl溶液呈 , 用離子方程式表示原因 .
(2)普通泡沫滅火器的鋼鐵容器里裝著一只小玻璃筒,其中玻璃筒內盛裝溶液,使用時,倒置滅火器,兩種藥液相混合就會噴出含二氧化碳的白色泡沫.產生此現象的離子方程式是 .
(3)NaHSO3溶液呈性,原因 .
(4)在25℃下,向濃度均為0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化學式),生成該沉淀的離子方程式為 . 已知25℃時Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,體積均為0.25 L 的兩個恒容密閉容器中發生可逆反應:N2(g)+3H2(g)2NH3(g)△H=﹣92.6 kJ/mol.實驗測得起始、平衡時數據如下表( )
容器編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出熱量:23.15kJ |
② | 0.8 | 2.4 | 0.4 | 放出熱量:Q |
A.容器①、②中反應的平衡常數相等,平衡時氮氣的轉化率相等
B.平衡時,兩個容器中NH3 的體積分數均為1/8
C.容器②中達平衡時放出的熱量Q=4.63 kJ
D.若容器①改為恒壓體系,充入0.25 L He,則平衡時放出的熱量大于23.15 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO ![]() )、c(HCO
)、c(HCO ![]() )都減少,其方法是( )
)都減少,其方法是( )
A.通入二氧化碳氣體
B.加入氫氧化鈉固體
C.通入氯化氫氣體
D.加入飽和石灰水溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用標準的0.2mol/L的鹽酸滴定待測的NaOH溶液,其實驗操作如下:A.用堿式滴定管取待測液NaOH溶液放入錐形瓶,滴加2﹣3滴酚酞指示劑.
B.用待測的NaOH溶液潤洗堿式滴定管.
C.檢查滴定管是否漏水.
D.取下酸式滴定管,用標準的鹽酸溶液潤洗后,再將標準的鹽酸注入酸式滴定管至刻度“0”以上2cm﹣3cm處,把酸式滴定管固定好,調節液面.
E.把滴定管用蒸鎦水洗凈,并分別固定在滴定管架兩邊.
F.另取錐形瓶,再重復滴定操作一次.
G.把錐形瓶放在酸式滴定管的下面,瓶下墊一張白紙,然后邊滴定邊搖動錐形瓶,直至終點,記下滴定管的液面所在刻度.
據上述滴定操作,完成下列填空:
(1)滴定操作的正確操作順序是(用上述各編號字母填寫)→E→→B→→→;
(2)G步操作中判斷滴定終點的依據是;
(3)D步驟的操作中液面應調節到 , 尖嘴部分應;
(4)酸式滴定管未用標準的鹽酸潤洗,待測溶液NaOH的測定值會;堿式滴定管未用待測的NaOH溶液潤洗,待測NaOH溶液的測定值會 . (填“偏高”、“偏低”或“無影響”.)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com