
如圖所示,兩圓圈相交的陰影部分表示圓圈內物質相互發生的反應,其中屬于氧化還原反應,但水既不作氧化劑也不作還原劑的是( )

A.甲 B.乙 C.丙 D.丁
科目:高中化學 來源:2017屆內蒙古高三上第一次月考化學試卷(解析版) 題型:選擇題
標準狀況下,①6.72L NH3 ②1.204×1023個 H2S ③5.6g CH4 ④0.5mol HCl,下列關系正確的是( )
A.體積大小:④>③>②>①
B.原子數目:③>①>④>②
C.密度大小:④>②>③>①
D.質量大小:④>③>②>①
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省定西市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
現有AlCl3和MgSO4混合溶液,向其中不斷加入NaOH溶液得到沉淀的量與加入NaOH溶液的體積如圖所示,原溶液中Cl-與SO42-的物質的量之比為( )

A. 3 :1 B.2 :3 C.6 :1 D.1 :3
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三暑假階段性考試化學試卷(解析版) 題型:填空題
(1)取300 mL 0.2 mol/L的 KI溶液與一定量的酸性 KMnO4 溶液恰好反應,生成等物質的量的 I2和 KIO3,則消耗 KMnO4的物質的量的是________mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色,溶液先變為淺綠色的離子方程式是 __,又變為棕黃色的原因是用離子方程式解釋_________________。
(3)在 100 mLFeBr2 溶液中通入標準狀況下2.24 L Cl2,溶液中有 1/4的 Br-被氧化成單質 Br2,則原 FeBr2溶液中 FeBr2 的物質的量濃度為________。
(4)三氟化氮(NF3)是一種無色,無味的氣體,它是微電子工業技術的關鍵原料之一,三氟化氮在潮濕的空氣中與水蒸氣能發生氧化還原反應,其反應的產物有:HF、NO和HNO3,請根據要求回答下列問題:
①寫出該反應的化學方程式 _,反應中生成0.2 mol HNO3,轉移的電子數目為_______________________。
②NF3無色、無臭,但一旦在空氣中泄漏,還是易于發現,判斷該氣體泄漏時的現象是_________________。
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三暑假階段性考試化學試卷(解析版) 題型:選擇題
鉍(Bi)位于元素周期表中第ⅤA族,其價態為+3時較穩定,鉍酸鈉(NaBiO3)溶液呈無色。現取一定量的硫酸錳(MnSO4)溶液,向其中依次滴加下列溶液,對應實驗現象如表所示:
加入溶液 | ①適量鉍酸鈉溶液 | ②過量的雙氧水 | ③適量KI?淀粉溶液 |
實驗現象 | 溶液呈紫紅色 | 溶液紫紅色消失,產生氣泡 | 溶液變成藍色 |
則NaBiO3、KMnO4、I2、H2O2的氧化性由強到弱的順序為( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三暑假階段性考試化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.將100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒數目為0.01NA
B.Na2O2與足量的水反應生成1 mol O2,轉移電子數目為2NA
C.某密閉容器中有2 mol SO2和1 mol O2,在一定條件下充分反應,轉移的電子數為4NA
D.18 g重水(D2O)所含的電子數為NA
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省桂林市高三上第二次月考化學試卷(解析版) 題型:填空題
氯化亞銅(CuCl)常用作有機合成工業中的催化劑,是一種白色粉末;微溶于水、不溶于乙醇及稀硫酸。下圖是工業上用印刷電路的蝕刻液的廢液(含Fe3+、Cu2+、Fe2+、Cl-)生產CuCl的流程:
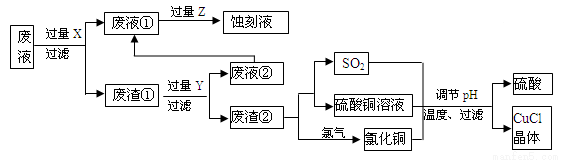
按要求回答下列問題:
⑴ 廢液①的主要含有的金屬陽離子是__________(填化學符號,下同);廢渣①的成分是_____________,Y為__________。
⑵廢液①與Z反應的離子方程式為:______________________。
⑶ 寫出廢渣②生成二氧化硫的化學方程式_____________________。
⑷ 為得到純凈的CuCl晶體,可用下列_________(填序號)進行洗滌。
a.純凈水 b.乙醇 c.稀硫酸 d.氯化銅溶液
⑸ 生產過程中調節溶液的pH不能過大的原因是___________________。
⑹ 寫出產生CuCl的離子方程式_______________________。
⑺ 氯化亞銅的定量分析:
① 稱取樣品0.25g加入10mL過量的FeCl3溶液250mlL錐形瓶中,不斷搖動;
② 待樣品溶解后,加水50mL和2滴指示劑;
③ 立即用0.10 mol·L-1硫酸鈰標準溶液滴至綠色出現為終點;
④ 重復三次,消耗硫酸鈰溶液平均體積為25.00mL。
已知:CuCl的分子式量為99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
則CuCl的純度為____________。
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省桂林市高三上第二次月考化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.石灰石、生石灰、熟石灰均屬于堿
B.Na2O、MgO、Al2O3均屬于堿性氧化物
C.根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體
D.根據電解質在水溶液中電離的程度,將電解質分為強電解質和弱電解質
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省高二上9月月考化學卷(解析版) 題型:選擇題
100 mL濃度為2 mol·L-1的鹽酸跟過量的鋅片反應,為加快反應速率,又不影響生成氫氣的總量,可采用的方法是
A.加入適量的6 mol·L-1的鹽酸 B.加入數滴氯化銅溶液
C.加入適量蒸餾水 D.加入適量的氯化鈉溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com