
【題目】下面列出了幾組物質,請將物質的合適組號填寫在空格上。
①金剛石與“足球烯”、C60;②氧氣(O2)與臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦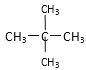 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分異構體___。
【答案】③ ④⑥ ⑦
【解析】
①金剛石與“足球烯”、C60是碳元素組成的不同單質,互為同素異形體;②氧氣(O2)與臭氧(O3)是氧元素組成的不同單質,互為同素異形體;③16O、17O和18O是氧元素的不同核素,互為同位素;④CH4和CH3CH2CH3,兩者結構相似,分子組成相差一個CH2原子團,互為同系物;⑤乙烯和乙烷是兩種不同物質;⑥![]() 和
和![]() ,兩者結構相似,分子組成相差一個CH2原子團,互為同系物;⑦
,兩者結構相似,分子組成相差一個CH2原子團,互為同系物;⑦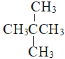 和
和![]() ,兩者分子式相同,結構式不同,互為同分異構體。
,兩者分子式相同,結構式不同,互為同分異構體。
⑴同位素是質子數相同,中子數不同的不同核素互稱, 16O、17O和18O是氧元素的不同核素,故答案為:③。
⑵同系物是結構相似,分子組成相差一個或若干個CH2原子團,④CH4和CH3CH2CH3; ⑥![]() 和
和![]() ,兩組結構分別相似,分子組成相差一個CH2原子團,互為同系物;故答案為:④⑥。
,兩組結構分別相似,分子組成相差一個CH2原子團,互為同系物;故答案為:④⑥。
⑶同分異構體是分子式相同,結構式不同,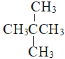 和
和![]() 兩者分子式相同,結構式不同,互為同分異構體;故答案為:⑦。
兩者分子式相同,結構式不同,互為同分異構體;故答案為:⑦。


科目:高中化學 來源: 題型:
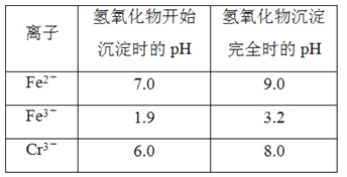
【題目】欲降低廢水中重金屬元素鉻的毒性,可將Cr2O![]() 轉化為Cr(OH)3沉淀除去。已知該條件下:
轉化為Cr(OH)3沉淀除去。已知該條件下:
(1)某含鉻廢水處理的主要流程如圖所示:
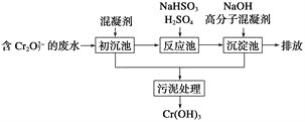
①初沉池中加入的混凝劑是K2SO4·Al2(SO4)3·2H2O,其作用為(用離子方程式表示)____。
②反應池中發生主要反應的離子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根據“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此過程中發生主要反應的離子方程式是_____、____。證明Cr3+沉淀完全的方法是____。
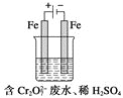
(2)工業可用電解法來處理含Cr2O![]() 廢水。實驗室利用如圖裝置模擬處理含Cr2O72-的廢水,陽極反應式是Fe-2e-===Fe2+,陰極反應式是2H++2e-===H2↑。Fe2+與酸性溶液中的Cr2O72-反應的離子方程式是_____,得到的金屬陽離子在陰極區可沉淀完全。用電解法處理該溶液中0.01molCr2O72-時,至少得到沉淀的質量是____g。
廢水。實驗室利用如圖裝置模擬處理含Cr2O72-的廢水,陽極反應式是Fe-2e-===Fe2+,陰極反應式是2H++2e-===H2↑。Fe2+與酸性溶液中的Cr2O72-反應的離子方程式是_____,得到的金屬陽離子在陰極區可沉淀完全。用電解法處理該溶液中0.01molCr2O72-時,至少得到沉淀的質量是____g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某化學反應的平衡常數表達式為K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的溫度下該反應的平衡常數如下表所示:

下列有關敘述不正確的是( )
A. 該反應的化學方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定體積的密閉容器中加入CO2和H2各1 mol,5 min后溫度升高到830 ℃,此時測得CO2為0.4 mol時,該反應達到平衡狀態
C. 某溫度下,如果平衡濃度符合下列關系式:(CO2)/3(CO)=(H2O)/5(H2),判斷此時的溫度是1 000 ℃
D. 該反應為吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海藻中含有豐富的、以離子形式存在的碘元素。如圖是實驗室從海藻里提取碘的流程中的一部分。

下列判斷正確的是( )
A.步驟①③的操作分別是過濾、萃取
B.可用淀粉溶液檢驗步驟②的反應是否進行完全
C.步驟③中加入的有機溶劑是四氯化碳或乙醇
D.步驟④的操作是過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用H2還原WO3制備金屬W的裝置如圖所示(Zn粒中往往含有硫等雜質,焦性沒食子酸溶液用于吸收少量氧氣),下列說法正確的是

A. ①、②、③中依次盛裝KMnO4溶液、濃H2SO4、焦性沒食子酸溶液
B. 管式爐加熱前,用試管在④處收集氣體并點燃,通過聲音判斷氣體純度
C. 結束反應時,先關閉活塞K,再停止加熱
D. 裝置Q(啟普發生器)也可用于二氧化錳與濃鹽酸反應制備氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數的值為NA,下列說法正確的是
A. 標準狀況下,2.24LCH3OH分子中共價鍵的數目為0.5NA
B. 1 L1 mol·L-1HCl溶液中含有NA個HCl分子
C. 12.0 g熔融的NaHSO4中含有的陽離子數為0.1NA
D. 1mol SO2與足量O2在一定條件下充分反應生成SO3,共轉移2 NA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含鋅廢渣及粉塵是危險廢物,堿浸電解法處理可得鋅粉。但若其中存在氯,則鋅質量就嚴重下降,對電極板也有嚴重腐蝕作用。工業上模擬堿浸電解法處理含鋅質量分數為16%的廢料(主要成分為ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu雜質)工藝如圖:
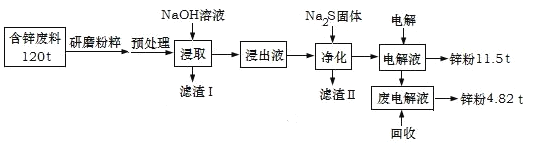
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等離子
ⅱ.濾渣Ⅱ的主要成分為:Na2Pb(OH)xS![]()
(1)從物質分類的角度看,ZnO屬于__,其與NaOH溶液發生反應的離子方程式為__。
(2)“濾渣Ⅰ”的主要成分為___。
(3)下表是“預處理”的2種除氯方案中粉塵氯的去除率和鋅損失率分析表格可知,首選的“除氯劑”為___,原因是____。
除氯劑 | 堿(NaOH) | 碳酸鈉 |
氯去除率/% | 78.75 | 83.69 |
鋅損失率/% | 0.26 | 0.28 |
價格/t | 7200元 | 3600元 |
(4)“電解”過程中陰極的電極反應式為____。
(5)鋅的總回收率為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
Ⅰ.(1)在200℃、101kPa時,0.5molH2(g)與足量I2(g)完全反應放出7.45kJ的熱量,該反應的熱化學方程式表示為________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 則:反應①中,ΔS______(選填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的電離平衡曲線如圖所示,試回答下列問題:
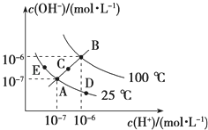
(3)圖中五點KW間的關系是__________________.
(4)若從A點到D點,可采用的措施是________.
a.升溫 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E對應的溫度下,在pH=9的NaOH溶液與pH=4的H2SO4 溶液中,水電離出的H+濃度之比為:________,若將兩溶液混合所得溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一容積為1L的密閉容器中加入一定量的X、Y,發生化學反應aX(g)+2Y(s) ![]() bZ(g) △H<0。圖是容器中X、Z的物質的量濃度隨時間變化的曲線。根據以上信息,下列說法正確的是
bZ(g) △H<0。圖是容器中X、Z的物質的量濃度隨時間變化的曲線。根據以上信息,下列說法正確的是
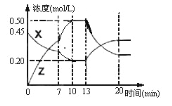
A. 根據上圖可求得方程式中a∶b=1:3
B. 推測在第7min時曲線變化的原因可能是升溫
C. 推測在第13min時曲線變化的原因可能是降溫
D. 用X表示0~10min內該反應的平均速率為v(X)=0.045mol/(L·min)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com