
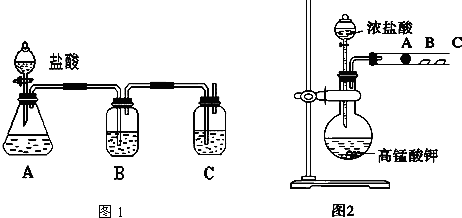
分析 (1)圖1是比較非金屬性強弱,元素的非金屬性越強,其最高價氧化物的水化物酸性越強,強酸能和弱酸鹽反應生成弱酸,所以圖1中用A制取二氧化碳,用B洗氣,用C裝置檢驗碳酸和硅酸酸性強弱;
(2)圖2實驗目的是比較鹵族元素性質遞變規律,元素的非金屬性越強,其單質的氧化性越強,要檢驗氧化性強弱順序:Cl2>Br2>I2,根據鹵素單質之間的置換反應判斷即可,據此分析解答.
解答 解:(1)圖1是比較非金屬性強弱,元素的非金屬性越強,其最高價氧化物的水化物酸性越強,強酸能和弱酸鹽反應生成弱酸,所以圖1中用A制取二氧化碳,鹽酸具有揮發性,所以生成的二氧化碳中含有HCl,HCl也能和硅酸鈉反應生成硅酸,為防止HCl干擾實驗,用B洗氣,用C裝置檢驗碳酸和硅酸酸性強弱,則A中盛放試劑是Na2CO3溶液、B中盛放試劑是飽和的NaHCO3溶液、C中盛放試劑是硅酸鈉溶液;
故答案為:Na2CO3溶液;飽和的NaHCO3溶液;硅酸鈉溶液;除去二氧化碳中的雜質HCl;
(2)圖2實驗目的是比較鹵族元素性質遞變規律,元素的非金屬性越強,其單質的氧化性越強,要檢驗氧化性強弱順序:Cl2>Br2>I2,根據鹵素單質之間的置換反應判斷即可,
氯氣和NaBr發生置換反應生成紅棕色物質溴,離子反應方程式為Cl2+2Br-=Br2+2Cl-;
溴和KI反應生成紫色物質碘,碘遇淀粉試液變藍色,所以B處試紙顯藍色;
氯氣、溴和碘都毒,不能直接排空,用NaOH吸收,防止污染空氣,
故答案為:Cl2+2Br-=Br2+2Cl-;試紙變藍色;處理尾氣.
點評 本題考查性質實驗方案設計,為高頻考點,明確實驗原理及物質性質性質是本題關鍵,注意物質檢驗時要排除其它物質的干擾,知道常見元素化合物性質,題目難度不大.


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1 mol O2與Na完全反應,轉移電子數一定為4NA | |
| B. | 22.4 L NH3中含有共價鍵的數目為3NA | |
| C. | 142 g Na2SO4和Na2HPO4混合物中含有的陰、陽離子總數是3NA | |
| D. | 標準狀況下,11.2 L SO3所含的分子數目為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溴乙烷$\stackrel{AgNO_{3}溶液}{→}$淺黃↓ | |
| B. | 溴乙烷$→_{HNO_{3}}^{AgNO_{3}}$淺黃↓ | |
| C. | 溴乙烷$→_{△}^{NaOH和水}$$→_{AgNO_{3}溶液}^{HNO_{3}}$淺黃↓ | |
| D. | 溴乙烷$→_{△}^{NaOH和乙醇}$$\stackrel{AgNO_{3}溶液}{→}$淺黃↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com