
【題目】某同學設計了如圖所示元素周期表,已知Z元素的最外層電子數是次外層的3倍。空格中均有對應的元素填充。下列說法正確的是
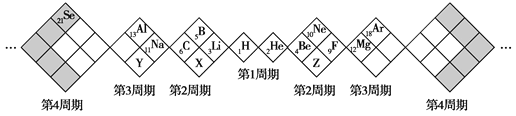
A.白格中都是主族元素,灰格中都是副族元素
B.X、Y分別與Z形成的化合物都只有兩種
C.X、Y元素最高價氧化物對應的水化物酸性:X>Y
D.X、Y、Z的氣態氫化物中最穩定的是X的氫化物
【答案】C
【解析】
按照排布規律,前3周期,一側的相同位置的元素位于同一主族,比如B和Al同主族,均在H的左側,均處于棱形的頂部空格內。則可知X、Y同主族,且X為N,Y為P,Z為O。到了第四周期,出現灰色空格,填充副族元素,如Se。
A、按照圖示,白格填充的為主族元素和稀有氣體元素,灰格填充的為副族元素,A錯誤;
B、X和Z,可以形成NO、NO2、N2O5等氮氧化物,不止2種,B錯誤;
C、X的最高價氧化物對應的水化物為HNO3,Y的最高價氧化物對應的水化物為H3PO4,同主族元素,同上到下非金屬性減弱,非金屬性越強,最高價氧化物對應的水化物的酸性越強,則HNO3>H3PO4;C正確;
D、非金屬性越強,氣態氫化物的穩定性越強,同主族元素,同上到下非金屬性減弱,同周期元素,從左到右,非金屬性增強,則非金屬性排序為O>N>P,氫化物最強的是Z的氫化物,H2O;D錯誤;
答案選D。


科目:高中化學 來源: 題型:
【題目】二氧化硫和氮氧化物都是常見的大氣污染物,回答下列相關問題。
Ⅰ.某溫度下氮氧化物與懸浮在大氣中的海鹽粒子相互作用時,涉及如下反應:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1<0其平衡常數為K1
2ClNO(g) △H1<0其平衡常數為K1
ii. 2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) △H2<0 其平衡常數為K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常數為K2
(1)現有反應4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g), 則此反應的平衡常數K3=_______(用K1、K2表示),反應熱△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g), 則此反應的平衡常數K3=_______(用K1、K2表示),反應熱△H3=_____(用△H1、△H2表示)。
(2)為研究不同條件對反應ii的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO2和足夠的NaCl(s),10min時反應ii達到平衡。測得平衡時NO2的轉化率α1(NO2) =50%,則:10min內υ(ClNO) =___________________,平衡常數K2=_________________;
II.除氮氧化物外,SO2也是重要的大氣污染物,需要對其進行吸收處理。
(3)若用一定量的NaOH溶液吸收SO2氣體后所得吸收液恰好呈中性,下列有關吸收液中粒子關系正確的是______________。
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工業上也可以用Na2SO3溶液吸收SO2,并用電解法處理吸收后所得溶液以實現吸收液的回收再利用,裝置如圖所示,則

①工作一段時間后,陰極區溶液的pH______(填“增大”“減小”或“不變”);
②寫出陽極的電極反應式_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修5:有機化學基礎]化合物M是一種香料,A與D是常見的有機化工原料,按下列路線合成化合物M: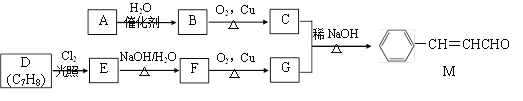
已知以下信息:
①A的相對分子質量為28
回答下列問題:
(1)A的名稱是___________,D的結構簡式是___________。
(2)A生成B的反應類型為________,C中官能團名稱為___________。
(3)E生成F的的化學方程式為___________。
(4)下列關于G的說法正確的是___________。(填標號)
a.屬于芳香烴
b.可與FeCl3溶液反應顯紫色
c.可與新制的Cu(OH)2共熱生成紅色沉淀
d.G分子中最多有14個原子共平面
(5)化合物M的同系物N比M的相對分子質量大14,N的同分異構體中同時滿足下列條件的共有________種(不考慮立體異構)。
①與化合物M含有相同的官能團;②苯環上有兩個取代基
(6)參照上述合成路線,化合物X與Y以物質的量之比2:1反應可得到化合物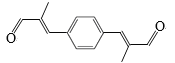 ,X的結構簡式為________,Y的結構簡式為________。
,X的結構簡式為________,Y的結構簡式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】觀察1s軌道電子云示意圖,判斷下列說法正確的是( )

A.一個小黑點表示1個自由運動的電子,圖中有無數個電子
B.1s軌道的電子云形狀為圓形的面
C.電子在1s軌道上運動像地球圍繞太陽旋轉
D.1s軌道電子云的點的疏密表示電子在某一位置出現概率的多少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時有三瓶溶液:
時有三瓶溶液:![]() 的鹽酸、
的鹽酸、![]() 的醋酸溶液和
的醋酸溶液和![]() 的氫氧化鈉溶液,下列說法正確的是( )
的氫氧化鈉溶液,下列說法正確的是( )
A.中和等體積![]() 的氫氧化鈉溶液,所需
的氫氧化鈉溶液,所需![]() 醋酸溶液的體積大于
醋酸溶液的體積大于![]() 鹽酸的體積
鹽酸的體積
B.等體積![]() 鹽酸和
鹽酸和![]() 醋酸溶液中分別加入少量相同的鋅粒,鹽酸中鋅粒先反應完
醋酸溶液中分別加入少量相同的鋅粒,鹽酸中鋅粒先反應完
C.當![]() 的醋酸溶液和
的醋酸溶液和![]() 的氫氧化鈉溶液混合得到
的氫氧化鈉溶液混合得到![]() 的溶液時,該溶液中
的溶液時,該溶液中![]() 大于
大于![]()
D.![]() 時
時![]() 的鹽酸、
的鹽酸、![]() 的醋酸溶液中水電離出的
的醋酸溶液中水電離出的![]() 均為
均為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年10月9日諾貝爾化學獎授予對鋰電池方面研究有貢獻的三位科學家。磷酸鐵鋰電池是綠色環保型電池,電池的總反應為:Li1-xFePO4+LixC6= LiFePO4+C6。磷酸亞鐵鋰(LiFePO4)可用作鋰離子電池正極材料,文獻報道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作為原料制備。
(1)基態Li原子中,核外電子排布式為_______,占據的最高能層的符號是_______。
(2)該電池總反應中涉及第二周期的元素的第一電離能由大到小的順序是_______(用元素符號表示)。
(3)FeCl3和LiFePO4中的鐵元素顯+3、+2價,請從原子結構角度解釋Fe為何能顯+3、+2價_______。
(4)苯胺(![]() )與甲苯(
)與甲苯(![]() )的相對分子質量相近,但苯胺的熔點(5.9℃)、沸點(184.4℃)分別高于甲苯的熔點(95.0℃)、沸點(110.6℃), 原因是_______。
)的相對分子質量相近,但苯胺的熔點(5.9℃)、沸點(184.4℃)分別高于甲苯的熔點(95.0℃)、沸點(110.6℃), 原因是_______。
(5)NH4H2PO4中,NH4+的空間構型為_______。與PO43-互為等電子體的分子或離子有_______(寫兩種),PO43-中磷原子雜化軌道類型為_______。
(6)鋰晶體為A2型密堆積即體心立方結構(見圖),晶胞中鋰的配位數為_______。若晶胞邊長為a pm,則鋰原子的半徑r為_______ pm。

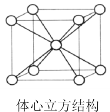
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了配制NH4+濃度與Cl-的濃度比為1:1的溶液,可在NH4Cl溶液中加入:①適量HCl②適量NaCl③適量的氨水④適量的NaOH,正確的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】直接排放含SO2的煙氣會形成酸雨,危害環境。工業上常采用催化還原法和堿吸收法處理SO2氣體。
(1)下圖所示:1mol CH4完全燃燒生成氣態水的能量變化和1mol S(g)燃燒的能量變化。

在催化劑作用下,CH4可以還原SO2生成單質S(g)、H2O(g)和CO2,寫出該反應的熱化學方程式________________________________________________________。
(2)焦炭催化還原二氧化硫的化學方程式為2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率與S2(g)的生成速率隨溫度變化的關系如圖所示:
S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率與S2(g)的生成速率隨溫度變化的關系如圖所示:
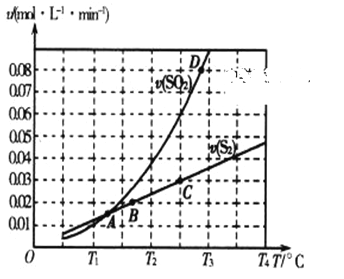
①A、B、C、D四點對應的狀態中,達到平衡狀態的有_____________(填字母)。
②該反應的△H_____0(填“>”“<”或“=”)。
③下列措施能夠增大SO2平衡轉化率的是______________。
A.降低溫度 B.增加C的量 C.減小容器體積 D.添加高效催化劑
(3)用氨水吸收SO2。25℃時,將含SO2的煙氣通入一定濃度的氨水中,當溶液顯中性時,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
(4)當吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如圖所示裝置電解所得NH4HSO4溶液可制得強氧化劑(NH4)2S2O8,請寫出電解NH4HSO4溶液的化學方程式_______________。
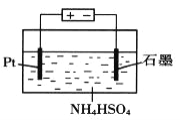
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K為化學平衡常數,其中K和溫度的關系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根據以上信息推斷以下說法正確的是
A. 此反應為放熱反應
B. 此反應只有達到平衡時,密閉容器中的壓強才不會變化
C. 此反應達到1 000℃時的反應速率比700℃時大
D. 該反應的化學平衡常數越大,反應物的轉化率越低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com