
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
分析 1molN2(g)與3molH2(g)反應生成2molNH3(g)放出的熱量是92.4kJ.恒溫恒壓下,反應前后氣體的物質的量發生變化,①與②中n(N2):n(H2)=1:3,二者為等效平衡,反應物的轉化率相同,②中參加反應的n(N2)是①中的2倍,據此判斷.
解答 解:1molN2(g)與3molH2(g)反應生成2molNH3(g)放出的熱量是92.4kJ,反應為可逆反應,物質不能完全反應,恒溫恒壓下,反應前后氣體的物質的量發生變化,①與②中n(N2):n(H2)=1:3,二者為等效平衡,反應物的轉化率相同,②中參加反應的n(N2)是①中的2倍,所以Q2=2 Q1<184.8 kJ.
故選A.
點評 考查熱化學方程式的意義、反應熱的計算、可逆反應特征、等效平衡等,難度中等,注意掌握等效平衡規律、理解熱化學方程式意義.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A的轉化率變大 | B. | 平衡向逆反應方向移動 | ||
| C. | C的體積分數變大 | D. | a>c+d |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所有主族元素原子的最外層電子數都等于元素的最高正化合價 | |
| B. | 多電子原子中,在離核較近的區域內運動的電子能量較低 | |
| C. | 第IA族元素從上到下,單質的熔點逐漸降低 | |
| D. | 元素周期表中位于金屬和非金屬分界線附近的元素屬于過渡元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 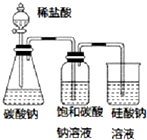 圖中的實驗現象能證明非金屬性:Cl>C>Si | |
| B. | 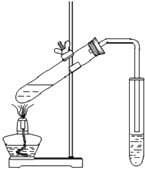 圖可用于實驗室制備并收集乙酸乙酯 | |
| C. |  圖中,氣體從a口進入時,可用于收集H2、CH4、NH3等氣體 | |
| D. | 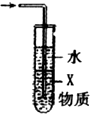 圖中X若為CCl4,可用于吸收NH3或HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com