
在900℃的空氣中合成出一種含鑭、鈣和錳 (摩爾比2 : 2 : 1) 的復合氧化物,其中錳可能以 +2、+3、+4 或者混合價態存在。為確定該復合氧化物的化學式,進行如下分析:
⑴ 準確移取25.00 mL 0.05301 mol·L-1的草酸鈉水溶液,放入錐形瓶中,加入25 mL蒸餾水和5 mL 6 mol·L-1的HNO3溶液,微熱至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。寫出滴定過程發生的反應的方程式;計算KMnO4溶液的濃度。
⑵ 準確稱取0.4460 g復合氧化物樣品,放入錐形瓶中,加25.00 mL上述草酸鈉溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分搖動,約半小時后得到無色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根據實驗結果推算復合氧化物中錳的價態,給出該復合氧化物的化學式,寫出樣品溶解過程的反應方程式。已知La的原子量為138.9。
⑴2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
KMnO4溶液濃度:![]() = 0.01910 (mol·L-1)
= 0.01910 (mol·L-1)
⑵根據:化合物中金屬離子摩爾比為 La : Ca : Mn = 2 : 2 : 1,鑭和鈣的氧化態分別為+3和+2,錳的氧化態為 +2 ~ +4,初步判斷
復合氧化物的化學式為La2Ca2MnO6+x, 其中 x = 0~1。
滴定情況:
加入C2O42-總量:25.00 mL ×0.05301 mol·L-1= 1.3253 mmol
樣品溶解后,滴定消耗高錳酸鉀:10.02 mL ×0.01910 mol·L-1 = 0.1914 mmol
樣品溶解后剩余C2O42-量: 0.1914 mmol × ![]() = 0.4785 mmol
= 0.4785 mmol
樣品溶解過程所消耗的C2O42-量: 1.3253 mmol -0.4785 mmol = 0.8468 mmol
在溶樣過程中,C2O42-變為CO2給出電子:
2 × 0.8468 mmol = 1.694 mmol
有兩種求解x的方法:
(1)方程法:
復合氧化物(La2Ca2MnO6+x)樣品的物質的量為:
0.4460 g / [(508.9 + 16.0 x) g·mol-1]
La2Ca2MnO6+x中,錳的價態為: [2 ×(6+x) -2 ×3 -2×2] = (2+2x)
溶樣過程中錳的價態變化為: (2+2 x - 2) = 2 x
錳得電子數與C2O42-給電子數相等:
2 x× 0.4460 g / [(508.9 + 16.0 x) g·mol-1] = 2 ×0.8468 ?? 10-3 mol
x = 1.012 ≈ 1
(2)嘗試法
因為溶樣過程消耗了相當量的C2O42-,可見錳的價態肯定不會是+2價。若設錳的價態為+3價,相應氧化物的化學式為La2Ca2MnO6.5, 此化學式式量為516.9 g·mol-1, 稱取樣品的物質的量為:
0.4460 g / (516.9 g·mol-1) = 8.628 ×10-4 mol
在溶樣過程中錳的價態變化為
1.689× 10-3 mol / (8. 628×10-4 mol) = 1.96
錳在復合氧化物中的價態為: 2 + 1.96 = 3.96
3.96與3差別很大,+3價假設不成立;
而結果提示Mn更接近于+4價。
若設Mn為+4價, 相應氧化物的化學式為La2Ca2MnO7, 此化學式式量為524.9 g· mol-1。
錳在復合氧化物中的價態為:2 + 2 × 0.8468 ×10-3 / (0.4460 / 524.9) = 3.99 ≈ 4
假設與結果吻合,可見在復合氧化物中,Mn為+4價。
該復合氧化物的化學式為La2Ca2MnO7
溶樣過程的反應方程式為:
La2Ca2MnO7 + C2O42- + 14H+ = 2La3+ + 2Ca2+ + Mn2+ + 2CO2 + 7H2O
⑴ 此過程為標準溶液的標定,根據關系式5C2O42-~2MnO4-,用C2O42-標準溶液標定出MnO4-的濃度。
⑵該分析過程屬于容量分析的返滴定類型,用KMnO4滴定過量的C2O42-。根據電子得失守恒關系,可列出下式
Mn元素得失電子數+5×n(MnO4-)=2×n(C2O42-)
求得Mn元素得失電子的物質的量為1.694 mmol
設復合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物質的量,進而求得滴定過程中錳元素氧化數的變化,最終確定氧化物中錳的氧化數。


科目:高中化學 來源: 題型:閱讀理解
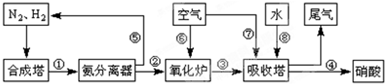
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
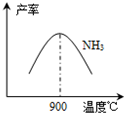
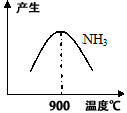
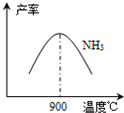 (3)N2和H2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH3產率如圖所示.溫度高于900℃時,NH3產率下降的原因
(3)N2和H2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH3產率如圖所示.溫度高于900℃時,NH3產率下降的原因
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2010-2011學年北京市石景山區高三統一測試(理綜)化學部分 題型:填空題
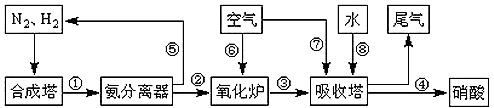
(16分)工業合成氨與制備硝酸一般可連續生產,流程如下:

(1)工業生產時,制取氫氣的一個反應為:CO+H2O(g) CO2+H2。t℃時,往1L密閉容器中充入0.2mol
CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K= (填計算結果)。
CO2+H2。t℃時,往1L密閉容器中充入0.2mol
CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K= (填計算結果)。
(2)合成培中發生反應N2(g)+3H2(g) 2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1
300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1
300℃(填“>”、“<”或“=”)。
|
T/℃ |
T1 |
300 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(3) N2和H2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH3產率如圖所示。溫度高于900℃時,NH3產率下降的原因 。
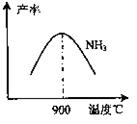
(4)在上述流程圖中,氧化爐中發生反應的化學方程式為 。
(5)硝酸廠的尾氣含有氮的氧化物,如果不經處理直接排放將污染空氣。目前科學家探索利用燃料氣體中的甲烷等將氮的氧化物還原為氮氣和水,反應機理為:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H= -574kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
則甲烷直接將N02還原為N2的熱化學方程式為: 。
(6)氨氣在純氧中燃燒,生成一種單質和水,試寫出該反應的化學方程式 ,科學家利用此原理,設計成氨氣一氧氣燃料電池,則通入氨氣的電極是 (填“正極”或“負極”);堿性條件下,該電極發生反應的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源:石景山區一模 題型:問答題
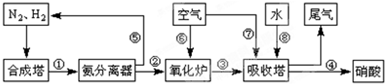
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化學 來源:浙江省月考題 題型:填空題
 CO2+H2。t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K=________(填計算結果)。
CO2+H2。t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K=________(填計算結果)。 2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 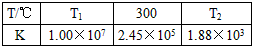
查看答案和解析>>
科目:高中化學 來源:北京模擬題 題型:填空題

 CO2+H2。t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K=________(填計算結果)。
CO2+H2。t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K=________(填計算結果)。 2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 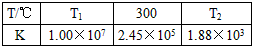

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com