
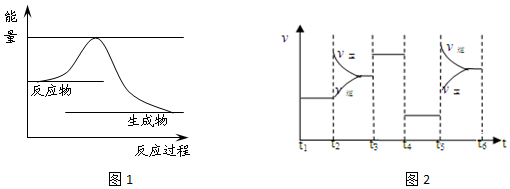
分析 (1)反應中使用催化劑后能降低反應的活化能,進而加快反應速率;
(2)K為生成物濃度冪之積與反應物濃度冪之積的比,書寫平衡常數表達式時,固體和純液不代入表達式,由圖中反應物的總能量比生成物的總能高可知正反應為反熱反應;
(3)t2時引起v正突變、v逆漸變,且逆反應速率與原來曲線有接觸點,只能是改變濃度;該反應反應前后氣體體積改變的可逆反應,t3條件改變時正逆反應速率同等程度的增大,只能是加入催化劑;t5時引起v逆大變化、v正小變化,平衡逆向移動,改變的條件是增大壓強或升高溫度.
解答 解:(1)加入催化劑,降低反應的活化能,但反應熱不變,應為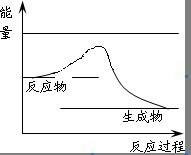 ,故答案為:
,故答案為: ;
;
(2)書寫平衡常數表達式時,固體和純液不代入表達式,所以平衡常數K=$\frac{{c}^{6}(CO)}{c({N}_{2})}$,因正反應放熱,則升高溫度平衡逆向移動,則平衡常數減小,
故答案為:$\frac{{c}^{6}(CO)}{c({N}_{2})}$;減小;
(3)t2時引起v正突變、v逆漸變的原因是,增大了氮氣的濃度,平衡正向正向移動,v正>v逆,t3時速率變大,但平衡未移動,而兩邊的化學計量數不等,故不是增大壓強,而引起變化的因素是加入(使用)了(正)催化劑;t5時引起v逆、v正都變大,但v逆>v正平衡正向移動,該反應為放熱反應,且為體積增大的反應,所以變化的原因是升高溫度或縮小容器體積,
故答案為:增大了氮氣的濃度;加入(使用)了(正)催化劑;升高溫度或縮小容器體積.
點評 本題考查化學平衡的計算,為高頻考點,把握K的意義、化學平衡移動為解答的關鍵,側重分析與應用能力的考查,注意平衡常數表達式中不能出現固體,題目難度不大.


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:解答題
| 實驗方法 | 實驗現象及結論 |
| 取少量待測物于試管中,加水溶解后,滴加少量稀硫酸 | 出現無色氣體溢出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醋酸溶液與氫氧化鈉溶液反應的離子方程式為H++OH-=H2O | |
| B. | H2S在水溶液中的電離:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃燒熱為890.3 kJ•mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 雙氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100mL 0.5 mol/L MgCl2溶液 | B. | 200mL 0.25 mol/L KCl溶液 | ||
| C. | 100mL 0.5 mol/L HCl溶液 | D. | 100mL 0.5 mol/L NaClO溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以上物質能導電的是④⑥⑩ | |
| B. | 以上物質屬于電解質的是①②③④⑧⑨⑩ | |
| C. | 屬于非電解質的是②⑤⑦ | |
| D. | 以上物質中,溶于水能夠導電的物質是①②④⑤⑦⑧⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
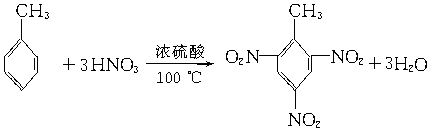 .
.查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上第二次模擬化學試卷(解析版) 題型:選擇題
某同學采用硫鐵礦焙燒,取焙燒后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)制取七水合硫酸亞鐵(FeSO4·7H2O),設計了如下流程:
下列說法不正確的是
A.溶解燒渣選用足量硫酸,試劑X選用鐵粉
B.固體1中一定含有SiO2,控制p H是為了使Al3+轉化為Al(OH)3,進入固體2
H是為了使Al3+轉化為Al(OH)3,進入固體2
C.從溶液2得到FeSO4·7H2O產品的過程中,須控制條件防止其氧化和分解
D.若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO4·7 H2O
H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com