
 某位同學在查閱資料時發現含氮化合物有以下性質:
某位同學在查閱資料時發現含氮化合物有以下性質:分析 本題為探究題,探究濃硝酸與銅、銀等不活潑金屬反應時除生成NO2氣體外還有少量NO生成,涉及NO2與N2O4間的轉化,及NO很容易被空氣中的氧氣氧化等性質,解題關鍵是消除彼此間的干擾,據此分析解答;
(1)裝置中本身有空氣,NO很容易被氧化;定量實驗,需要確保生成物能完全測定,E裝置就是為了吸收生成的氮氧化物的;
(2)NO遇氧氣很容易生成NO2,現象是無色變為紅棕色;
(3)裝置C中收集到的是N2O4,E中增重的質量應該是NO和O2的質量,可結合電子守恒計算固體中Cu或銀的質量,根據原子守恒及電荷守恒計算反應后溶液A中HNO3的濃度;
(4)銅、銀均能溶解在FeCl3溶液里,但銀可以轉化為氯化銀沉淀,因此只有知道生成氯化銀的質量,就可以確定混合物中各組分的含量.
解答 解:(1)利用通入的空氣將裝置內的空氣排盡,防止NO被氧化;第四步通N2的目的是將生成的NO和O2的混合氣體完全被E中NaOH溶液吸收,故答案為:排盡裝置中的空氣,防止生成的NO被氧化;保證反應產生的氣體完全被裝置E吸收;
(2)欲驗證NO可利用NO遇氧氣變紅棕色的性質,只要打開K2,持續通入氧氣,D中出現紅棕色氣體即可證明,故答案為:打開K2,持續通入氧氣,D中出現紅棕色氣體;
(3)N2O4的物質的量為$\frac{3.22g}{92g/mol}$=0.035mol,根據4NO+3O2+2H2O=4HNO3,設NO的物質的量為nmol,則O2的物質的量為0.75nmol,30n+32×0.75n=0.54,解得:n=0.01mol,設Cu的物質的量為xmol,銀的物質的量為ymol,則64x+108y=7,另外電子守恒式為:2x+y=0.035×2+0.01×3,解得:x=0.025mol,y=0.05mol,則Cu的質量為0.025mol×64g/mol=1.6g,則銅的質量分數為$\frac{1.6g}{7g}×100%$=22.9%;被還原的硝酸為0.035mol×2+0.01mol=0.08mol,實際消耗的HNO3為0.08mol+2x+y=0.18mol,剩余硝酸為13.5mol/L×0.1L-0.18mol=1.17mol,實驗后A中硝酸的濃度為:$\frac{1.17mol}{0.1L}$=11.7mol/L; 故答案為:22.9%;11.7;
(4)根據反應Ag+FeCl3?AgCl+FeCl2可知;當FeCl3溶液足量時固體完全溶解,生成的沉淀為AgCl,只要知道沉淀質量,Ag的質量即可求算,再結合固體的總質量,就可以計算合金中銅的質量分數,故答案為:反應中產生沉淀的質量.
點評 本題以探究銅、銀與硝酸反應產物為載體,考查了氧化還原發生過程中的電子守恒規律,以及化學反應中的原子守恒、溶液中的電荷守恒等,另外涉及物質的鑒別,考查較為綜合,中等難度.


科目:高中化學 來源: 題型:解答題
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 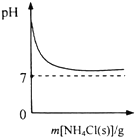 表示向NH3•H2O溶液中逐步加入NH4Cl固體后,溶液pH的變化 | |
| B. | 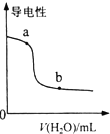 表示向NH3•H2O溶液中加水時溶液的導電性變化,則NH3•H2O溶液的pH:b>a | |
| C. | 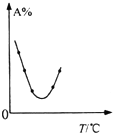 表示等量A在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2A(g)?B(g)+C(g),相同時間后測得A含量的曲線,則該反應的△H<0 | |
| D. | 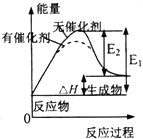 表示催化劑能改變化學反應的焓變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 電子由Pt電極流出,經外電路流向NiO電極 | |
| B. | Pt電極上發生的是還原反應 | |
| C. | NiO電極的電極反應式為NO+O2--2e-═NO2 | |
| D. | 每轉移2 mol電子,有1 mol O2-遷移到負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在pH為6.37及10.25時,溶液中c(CO32-)=c(HCO3-)=c(H2CO3) | |
| B. | 反應HCO3-+H2O═H2CO3+OH- 的平衡常數為10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,發生反應:CO32-+H2C2O4═HC2O4-+HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高溫下Mg2+得電子的能力比Rb+弱 | |
| B. | MgCl2對熱的穩定性比RbCl強 | |
| C. | 在一定條件下,Mg的金屬性比Rb強 | |
| D. | 銣的沸點比鎂低,及時抽走銣蒸氣使平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
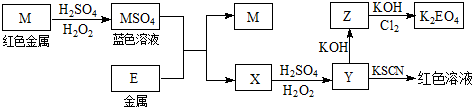
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com