科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H
2(g)、CO(g)和CH
3OH(l)的燃燒熱△H分別為-285.8kJ?mol
-1、-283.0kJ?mol
-1和-726.5kJ?mol
-1.請回答下列問題:
(1)用太陽能分解10mol液態水消耗的能量是
2858
2858
kJ;
(2)甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
;
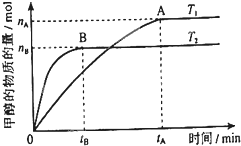
(3)在容積為2L的密閉容器中,由一定量的CO
2和H
2合成甲醇,在其他條件不變的情況下,溫度對反應的影響,實驗結果如右圖所示(注:T
1、T
2均大于300℃);
下列說法正確的是
②③
②③
(填序號)
①溫度為T
1時,從反應開始到平衡,生成甲醇的平均速率為v(CH
3OH)=
mol?L
-1?min
-1②該反應在T
1時的平衡常數比T
2時的大
③該反應的△H<0
④處于A點的反應體系從T
1變到T
2,達到平衡時容器中氣體密度減小
⑤處于A點時容器中的壓強比處于B點時容器中的壓強大
(4)在T
1溫度時,將1mol CO
2和3mol H
2充入一密閉恒容器中,充分反應達到平衡后,若CO
2轉化率為a,則容器內的壓強與起始壓強之比為
;
(5)在直接以甲醇為燃料的電池中,電解質溶液為酸性,負極的反應式為
CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
.

 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.請回答下列問題:
科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.請回答下列問題:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 (2011?江西)科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.請回答下列問題:
(2011?江西)科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.請回答下列問題: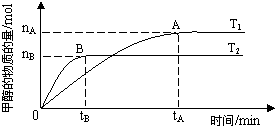 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1. 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1. 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1. 碳是化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質.
碳是化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質.