
【題目】含n克HNO3的稀溶液恰好與m克Fe完全反應,若HNO3只被還原為NO,則n:m可能是 ①5:1、②9:2、③3:1、④2:1、⑤4:1( )
A.②③⑤
B.①③④
C.②③④
D.①③
【答案】A
【解析】解:含n克HNO3的稀溶液恰好與m克Fe完全反應,生成硝酸鐵時,發生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,溶解Fe的質量最小,根據電子轉移守恒n(NO)= ![]() ×
× ![]() =
= ![]() mol,
mol,
根據氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即 ![]() mol+
mol+ ![]() mol×3=
mol×3= ![]() ,整理得整理得2n=9m,
,整理得整理得2n=9m,
生成硝酸亞鐵時溶解Fe的質量最大,根據電子轉移守恒n(NO)= ![]() ×
× ![]() =
= ![]() mol,
mol,
根據氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],
則 ![]() mol+2×
mol+2× ![]() mol=
mol= ![]() ,整理得n=3m
,整理得n=3m
故m的取值范圍為: ![]() n≤m≤
n≤m≤ ![]() n,②③⑤都符合,
n,②③⑤都符合,
故選A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】氯化亞鐵具有獨有的脫色能力,適用于染料、染料中間體、印染、造紙行業的污水處理.某課題小組設計如下方案制備氯化亞鐵并探究氯化亞鐵(Fe2+)的還原性.
某同學選擇下列裝置用氯化鐵制備少量氯化亞鐵(裝置不可以重復使用).查閱資料知,氯化鐵遇水劇烈水解,在加熱條件下氫氣還原氯化鐵生成FeCl2和HCl.
(1)實驗開始前應先檢查裝置的氣密性,請敘述裝置A氣密性檢驗的方法:
(2)氣流從左至右,裝置接口連接順序是a
(3)裝置C中干燥管中所盛試劑的名稱是: , 作用是:
(4)裝置C中酒精燈的作用是:
(5)為了測定氯化亞鐵的質量分數,某同學進行了如下實驗:
稱取實驗制備的氯化亞鐵樣品5.435g,配成溶液,用1.00molL﹣1酸性KMnO4標準溶液滴定至終點.(已知還原性Fe2+>Cl﹣)滴定結果如表所示:
滴定次數 | 標準溶液的體積 | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 1.04 | 25.03 |
2 | 1.98 | 25.99 |
3 | 3.20 | 25.24 |
①寫出滴定過程中所發生的2個離子方程式:
②樣品中氯化亞鐵的質量分數為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,PbR(R2﹣為SO42﹣或CO32﹣)的沉淀溶解平衡曲線如圖.已知Ksp(PbCO3)<Ksp(PbSO4),下列說法不正確的是( ) 
A.曲線a表示PbCO3
B.以PbSO4、Na2CO3和焦炭為原料可制備Pb
C.當PbSO4和PbCO3沉淀共存時,溶液中 ![]() =105
=105
D.向X點對應的飽和溶液中加入少量Pb(NO3)2 , 可轉化為Y點對應的溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的性質與用途具有對應關系的是( )
A.NH4HCO3受熱易分解,可用作化肥
B.NaHCO3溶液顯堿性,可用于制胃酸中和劑
C.SO2具有氧化性,可用于紙漿漂白
D.Al2O3具有兩性,可用于電解冶煉鋁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銦(In)被稱為信息產業中的“朝陽元素”。由“銦49In-114.8”不可能知道的是( )
A.銦元素的相對原子質量B.銦元素的原子序數
C.銦原子的相對原子質量D.銦原子的核電荷數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CH3﹣CH=CH2+HBr﹣→ ![]() (主要產物),1mol某烴A充分燃燒后可以得到8mol CO2和4mol H2O.該烴A在不同條件下能發生如下所示的一系列變化.
(主要產物),1mol某烴A充分燃燒后可以得到8mol CO2和4mol H2O.該烴A在不同條件下能發生如下所示的一系列變化. 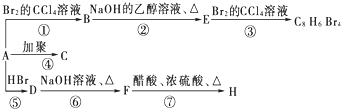
(1)A的化學式: , A的結構簡式: .
(2)上述反應中,①是反應,⑦是反應.(填反應類型)
(3)寫出C、D、E、H物質的結構簡式:C , D , E , H .
(4)寫出D→F反應的化學方程式 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com