
| 過程Ⅳ:B溶液中含有的離子 | 過程Ⅵ:B溶液中含有的離子 | |
| 甲 | 有Fe3+,無Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、無Fe2+ | 有Fe2+ |
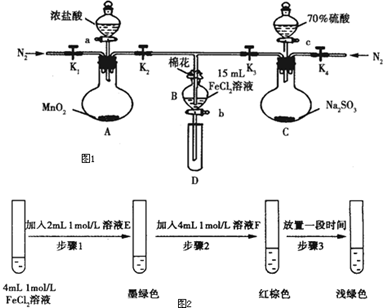
分析 (1)空氣中氧氣具有氧化性,能干擾實驗;
(2)氯氣、二氧化硫都有毒,不能直接排空,且氯氣、二氧化硫都能和NaOH溶液反應生成無毒物質,可以用堿液吸收;
(3)加熱條件下,濃鹽酸和二氧化錳反應生成氯化錳、氯氣和水;
(4)溶液中氫離子濃度越大反應速率越快;
(5)溶液顯酸性,檢驗SO42-應選擇BaCl2溶液;乙中第一次,說明Cl2不足,Cl2氧化性大于Fe3+,第二次有SO42-,說明發生SO2與Fe3+的反應,則氧化性Fe3+>SO2;丙中第一次有Fe3+,無Fe2+,則氧化性Cl2>Fe3+,第二次有Fe2+,說明發生SO2與Fe3+的反應,則氧化性Fe3+>SO2;
(6)增大反應物濃度平衡向正反應方向移動,減小反應物濃度,平衡逆向移動,根據混合物顏色變化判斷.
解答 解:(1)空氣中氧氣具有氧化性,能氧化亞鐵離子生成鐵離子而干擾實驗,為排除氧氣的干擾,用氮氣將裝置中的空氣排出,故答案為:排出裝置中的空氣,防止干擾實驗;
(2)氯氣、二氧化硫都有毒,不能直接排空,氯氣和水反應生成酸、二氧化硫屬于酸性氧化物,所以氯氣、二氧化硫都能和NaOH溶液反應生成無毒物質,可以用堿液吸收,則棉花浸潤的液體是NaOH溶液,
故答案為:NaOH溶液;
(3)加熱條件下,濃鹽酸和二氧化錳反應生成氯化錳、氯氣和水,反應方程式為MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)溶液中氫離子濃度越大反應速率越快,98%濃硫酸中氫離子濃度小于70%硫酸,所以70%硫酸反應速率較快,故答案為:70%硫酸中氫離子濃度大于98%的硫酸,因此反應速率更快;
(5)溶液顯酸性,檢驗SO42-應選擇BaCl2溶液;乙中第一次,說明Cl2不足,Cl2氧化性大于Fe3+,第二次有SO42-,說明發生SO2與Fe3+的反應,則氧化性Fe3+>SO2;丙中第一次有Fe3+,無Fe2+,則氧化性Cl2>Fe3+,第二次有Fe2+,說明發生SO2與Fe3+的反應,則氧化性Fe3+>SO2,
故答案為:乙、丙;
(6)①根據已知條件:FeCl3與SO2的反應經歷了中間產物FeSO3,溶液的紅棕色是FeSO3(墨綠色)與FeCl3(黃色)的混合色,所以可以借助氯化鐵和亞硫酸鈉溶液來確定假設是否成立,故答案為:Na2SO3;FeCl3;
②根據化學平衡:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨綠色),步驟3中,Fe3+消耗SO32-,c(SO32-)減小,平衡逆向移動,溶液顏色由紅棕色變為淺綠色,
故答案為:Fe3+消耗SO32-,c(SO32-)減小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨綠色)逆向移動,溶液顏色由紅棕色變為淺綠色.
點評 本題考查性質實驗方案設計,為高頻考點,涉及實驗基本操作過程、化學平衡移動原理、物質的制備、化學反應速率影響因素等知識點,明確實驗原理是解本題關鍵,注意氧化性強弱比較是解答難點,注意(4)題氫離子濃度影響反應速率,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙顯黃色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 實驗操作 | 實驗現象 | 實驗結論 |
| ① | 將鎂條投入5mL蒸餾水 | 微量氣泡 | Mg與蒸餾水緩慢反應 |
| ② | 將鎂條投入5mL飽和NaHCO3溶液中 | 鎂表面出現大量氣泡 | Mg與NaHCO3溶液劇烈反應 |
| ③ | 將鎂條投入5mLNaOH溶液中 | 現象不明顯 | Mg與NaOH溶液較難反應 |
| 實驗步驟 | 想象和結論 |
| 大試管中加入擦去氧化膜的鎂條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳 | B. | 石英 | C. | 鍺 | D. | 硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com