
 氮元素及其化合物在生產、生活中有著廣泛的應用.
氮元素及其化合物在生產、生活中有著廣泛的應用.分析 (1)根據電離常數Ka(HNO2)=5.0×10-4 Kb(NH3•H2O)=1.8×10-5判斷一水合氨的電離能力弱于亞硝酸,則銨根離子的水解能力強于亞硝酸根離子,溶液顯酸性,據此判斷;
(2)尿素在酸性條件下與硝酸根反應生成二氧化碳和氮氣;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1,
根據蓋斯定律:①+②可得;
(4)①反應進行到10min時測得CO2的物質的量為0.26mol,根據v=$\frac{△c}{△t}$計算;
②已知總反應的快慢由慢的一步決定,結合圖象變化趨勢進行判斷,反應快慢可以依據第一步和第二步反應的曲線斜率比較大小;再根據化學平衡常數概念寫K,注意固體不寫入表達式;
(5)①食鹽水做電解液電解得Cl2脫氮,根據氧化還原反應的規律可得反應;
②次氯酸鈉在酸性條件下氧化性增強,故控制電解液較低的pH有利于提高NO去除率.
解答 解:(1)電離常數Ka(HNO2)=5.0×10-4 Kb(NH3•H2O)=1.8×10-5,則NH3•H2O的電離能力較弱,相應的銨根離子的水解能力稍強,溶液顯酸性,所以NH4NO2溶液中離子濃度由大到小順序為:c(NO2-)>c(NH4+)>c(H+)>c(OH-);
故答案為:c(NO2-)>c(NH4+)>c(H+)>c(OH-);
(2)酸性條件下,亞硝酸根離子和尿素發生氧化還原反應生成兩種無毒氣體,根據元素守恒知,兩種無毒氣體應該是氮氣和二氧化碳氣體,離子反應方程式為:6H++5CO(NH2)2+6NO3-=5CO2↑+8N2↑+13H2O;
故答案為:6H++5CO(NH2)2+6NO3-=5CO2↑+8N2↑+13H2O;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1,
根據蓋斯定律:①+②可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-134kJ•mol-1;
故答案為:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-134kJ•mol-1;
(4)①體積為10L密閉容器中投入4molNH3和1molCO2,反應進行到10min時測得CO2的物質的量為0.26mol,v(CO2)=$\frac{(1mol-0.26mol)÷10L}{10min}$=0.0074mol/(L•min);
故答案為:0.0074mol/(L•min);
②由圖象可知在15分鐘左右,氨氣和二氧化碳反應生成氨基甲酸銨后不再變化,發生的是第一步反應,氨基甲酸銨先增大再減小最后達到平衡,發生的是第二步反應,從曲線斜率不難看出第二部反應速率慢,已知總反應的快慢由慢的一步決定,故合成尿素兩步反應中慢反應為H2NCOONH4(s)═CO(NH2)2(s)+H2O(g),根據化學平衡常數概念K=c(H20);
故答案為:c(H20);
(5)①電解食鹽水陽極產生氯氣作氧化劑,NO為還原劑,在堿性條件下的反應為:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O;
故答案為:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O;
②次氯酸鈉在酸性條件下氧化性增強,故控制電解液較低的pH有利于提高NO去除率;
故答案為:次氯酸鈉在酸性條件下氧化性增強.
點評 本題考查了了蓋斯定律求反應熱、化學平衡速率計算及常數K的表達式、氧化還原反應等,(5)中對電解食鹽水的產物判斷是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A | 化學變化 | 物理變化 |
| B | 氧化還原反應 | 分解反應 |
| C | 氧化還原反應 | 化合反應 |
| D | 中和反應 | 復分解反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2912 kJ | B. | 3236 kJ | C. | 2953 kJ | D. | 3867 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
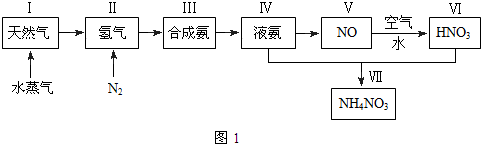
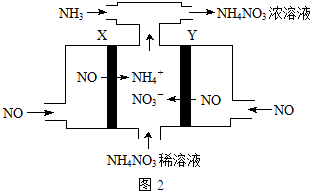
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
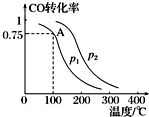 利用CO和H2可以合成甲醇,反應原理為CO(g)+2H2(g)═CH3OH(g).一定條件下,在容積為V L的密閉容器中充入a mol CO與2a mol H2合成甲醇,平衡轉化率與溫度、壓強的關系如圖所示.
利用CO和H2可以合成甲醇,反應原理為CO(g)+2H2(g)═CH3OH(g).一定條件下,在容積為V L的密閉容器中充入a mol CO與2a mol H2合成甲醇,平衡轉化率與溫度、壓強的關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
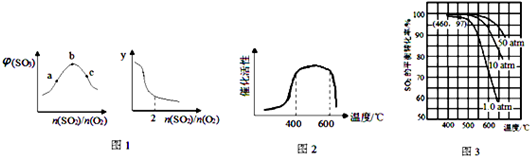
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com