
 .實驗室制取并檢驗氣體A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,將濕潤的紅色石蕊試紙靠近氣體,若試紙變藍,則是氨氣.
.實驗室制取并檢驗氣體A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,將濕潤的紅色石蕊試紙靠近氣體,若試紙變藍,則是氨氣.分析 U、W、X、Y、Z都是短周期元素,且原子序數依次增大.其中U與W可形成三角錐形分子A,則U為H,W為N,A為NH3,U與X可形成常溫下呈液態的分子B,A、B均為10電子分子,則X為O,B為H2O;X能與W形成兩種常見的離子化合物甲、乙,其化學式中原子個數甲多于乙,所以W是Na,其中甲是過氧化鈉,乙是氧化鈉;Y元素原子的K層電子數與M層電子數相同,則Y為Mg;Z元素是地殼中含量最多的金屬,則Z為Al,然后利用元素及其單質、化合物的性質來解答.
解答 解:U、W、X、Y、Z都是短周期元素,且原子序數依次增大.其中U與W可形成三角錐形分子A,則U為H,W為N,A為NH3,U與X可形成常溫下呈液態的分子B,A、B均為10電子分子,則X為O,B為H2O;X能與W形成兩種常見的離子化合物甲、乙,其化學式中原子個數甲多于乙,所以W是Na,其中甲是過氧化鈉,乙是氧化鈉;Y元素原子的K層電子數與M層電子數相同,則Y為Mg;Z元素是地殼中含量最多的金屬,則Z為Al,
(1)鋁的質子數為13,位于第三周期ⅢA族,原子的電子層數越多,半徑越大,同周期元素從左向右原子半徑在減小,則原子半徑為O<N<Al<Mg<Na,
故答案為:第三周期ⅢA族;O<N<Al<Mg<Na;
(2)U與X形成的18電子化合物為H2O2,其電子式為 ,實驗室用氯化銨和堿石灰反應制取氨氣,即堿與鹽反應生成新堿和新鹽,化學方程式為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,檢驗氨氣,可以利用氨氣的水溶液顯堿性,即用“使濕潤的紅色石蕊試紙變藍”;也可以用氨氣遇濃鹽酸產生白煙,即“用蘸有濃鹽酸的玻璃棒放在瓶口,產生白煙”,
,實驗室用氯化銨和堿石灰反應制取氨氣,即堿與鹽反應生成新堿和新鹽,化學方程式為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,檢驗氨氣,可以利用氨氣的水溶液顯堿性,即用“使濕潤的紅色石蕊試紙變藍”;也可以用氨氣遇濃鹽酸產生白煙,即“用蘸有濃鹽酸的玻璃棒放在瓶口,產生白煙”,
故答案為: ;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,將濕潤的紅色石蕊試紙靠近氣體,若試紙變藍,則是氨氣;
;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,將濕潤的紅色石蕊試紙靠近氣體,若試紙變藍,則是氨氣;
(3)A與W的最高價氧化物的水化物是硝酸,反應所得硝酸銨是強酸弱堿鹽,水解溶液呈酸性,水解反應方程式為NH4++H2O?NH3•H2O+H+,故答案為:酸;NH4++H2O?NH3•H2O+H+,導致氫離子濃度大于氫氧根離子的濃度,所以溶液呈酸性;
(4)26.4g的過氧化鈉與鋁和水發生2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑反應,因為所得溶液中僅有一種溶質,所以溶質為偏鋁酸鈉,則n(Na2O2):n(Al)=1:2,設過氧化鈉的物質的量為xmol,則鋁的物質的量為2xmol,所以78x+54x=26.4g,則x=0.2mol;所以生成氧氣的物質的量為0.1mol,鋁與堿反應生成氫氣的物質的量為:$\frac{0.2×2×3}{2}$=0.6mol,所以生成氣體的總物質的量為:0.7mol,體積為:0.7mol×22.4L/mol=15.68L,故答案為:NaAlO2;15.68L;
(5)Mg與二氧化碳的反應為2Mg+CO2 $\frac{\underline{\;點燃\;}}{\;}$2MgO+C,C與濃硝酸反應生成二氧化碳和二氧化氮,設二氧化碳的物質的量x,由電子守恒可知,x×4=($\frac{aL}{22.4L/mol}$-x)×1,解得x=$\frac{a}{22.4×5}$mol,
再由2Mg+CO2 $\frac{\underline{\;點燃\;}}{\;}$2MgO+C可知,Mg的物質的量為$\frac{a}{22.4×5}$mol×2=$\frac{2a}{22.4×5}$mol,
則Mg的質量為$\frac{2a}{22.4×5}$mol×24g/mol=$\frac{3a}{7}$,故答案為:$\frac{3a}{7}$.
點評 本題考查原子結構與元素周期律,元素的推斷是解答本題的關鍵,應熟悉分子的構型、10電子微粒及氧化還原反應來解答,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2 | B. | Fe3O4+4CO$\frac{\underline{\;高溫\;}}{\;}$ 3Fe+4CO2 | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2NaCl(熔融)$\frac{\underline{\;高溫\;}}{\;}$ 2Na+Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
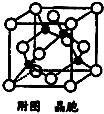
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
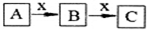 A、B、C、x均為中學化學常見物質,且A、B、C含有同一種元素,在一定條件下發生如圖所示的化學變化.則x不可能是( )
A、B、C、x均為中學化學常見物質,且A、B、C含有同一種元素,在一定條件下發生如圖所示的化學變化.則x不可能是( )| A. | C | B. | Al | C. | Fe | D. | O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
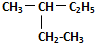 和
和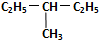 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  的系統命名:2-丙醇 的系統命名:2-丙醇 | B. | 明礬的化學式:KAl(SO4)2•12H2O | ||
| C. | CH4Si的結構式: | D. | H2O2的球棍模型: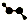 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 運液氯可用鋼瓶裝,車上應貼 標志.裝運濃硫酸可用鋁槽罐車,應貼 標志.裝運濃硫酸可用鋁槽罐車,應貼 標志 標志 | |
| B. | 冬天嚴禁在窗門緊閉的室內用煤餅爐取暖,因為生成的CO、SO2等容易引起中毒 | |
| C. | 用鋁鍋煮菜一般在起鍋之前才放鹽,既減少加碘鹽的損耗,又能增加鋁鍋的使用壽命 | |
| D. | 嚴禁在寫作業時將鉛筆放入口中啃咬,否則會引起鉛中毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氫氧化鈉 | 醋酸 | 鹽酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶體,則溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分別在等體積的②、④兩溶液加水稀釋100倍,所得溶液中水電離出的c(H+)相等 | |
| C. | ①、④兩溶液等體積混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③兩溶液混合,若所得溶液的pH=7,則c(CH3COO-)>c(Na+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com