
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
分析 ①高錳酸根離子為有色離子,不滿足溶液無色的條件;
②能使酚酞變紅的溶液中存在大量氫氧根離子,四種離子之間不反應,都不與氫氧根離子反應;
③加入Al能放出H2的溶液中存在大量氫離子和氫氧根離子,碳酸氫根離子與氫離子和氫氧根離子反應;
④四種離子之間不反應,為澄清透明溶液;
⑤有較多Fe3+的溶液中,鐵離子與硫氰根離子、碳酸氫根離子反應;
⑥酸性溶液中,硝酸根離子能夠氧化亞鐵離子、碘離子.
解答 解:①無色溶液中不會存在有色的MnO4-,在溶液中不能大量共存,故①錯誤;
②能使酚酞變紅的溶液為堿性溶液,溶液中存在大量氫氧根離子,CO32-、Na+、AlO2-、NO3-之間不發生反應,都不與氫氧根離子反應,在溶液中能夠大量共存,故②正確;
③加入Al能放出H2的溶液中存在大量氫離子或氫氧根離子,HCO3-、NH4+都與氫氧根離子反應,HCO3-與氫離子反應,在溶液中一定不能大量共存,故③錯誤;
④某澄清溶液中:Na+、Ba2+、Cl-、Cu2+之間不發生反應,為澄清透明溶液,在溶液中能夠大量共存,故④正確;
⑤有較多Fe3+的溶液中,Fe3+與SCN-、HCO3-發生反應,在溶液中不能大量共存,故⑤錯誤;
⑥酸性溶液中,NO3-與Fe2+、I-發生氧化還原反應,在溶液中不能大量共存,故⑥錯誤;
故選C.
點評 本題考查離子共存的判斷,為高考的高頻題,屬于中等難度的試題,注意明確離子不能大量共存的一般情況,如:能發生復分解反應的離子之間;能發生氧化還原反應的離子之間;能發生絡合反應的離子之間(如 Fe3+和 SCN-)等;還應該注意題目所隱含的條件,如:溶液的酸堿性,據此來判斷溶液中是否有大量的 H+或OH-;溶液的顏色,如無色時可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色離子的存在;溶液的具體反應條件,如“氧化還原反應”、“加入鋁粉產生氫氣”等.


 長江作業本同步練習冊系列答案
長江作業本同步練習冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 該現象說明了NaHCO3難溶于水 | |
| B. | 濾液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 濾液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 濾液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4 和C3H6的混合物的質量為a g,所含碳氫鍵數目為$\frac{a{N}_{A}}{7}$ | |
| B. | 標準狀況下,2.24 L 2H35Cl 中所含中子數為1.8NA | |
| C. | 50 mL 12 mol•L-1 鹽酸與足量MnO2 共熱,轉移的電子數為0.3NA | |
| D. | 1 L O.lmol•L-1的NaHCO3 溶液中HCO3-和CO32-的離子數之和為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
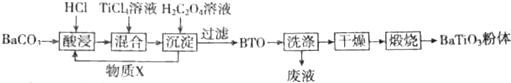
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 測定中和熱時,大小兩燒杯間填滿碎紙的作用只是固定小燒杯 | |
| B. | 用50mL 0.50mo1•L-1的氫氧化鈉溶液,分別與50mL 0.50mo1•L-1的鹽酸和50mL 0.25mo1•L-1的硫酸充分反應,兩反應測定的中和熱相等 | |
| C. | 不能用銅絲代替玻璃棒攪拌酸堿混合液 | |
| D. | 酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用玻璃棒攪拌 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,1molNa2O2和22.4LCO2反應,轉移電子數為1mol | |
| B. | 將鈉投入到CuSO4溶液中,可以置換生成Cu | |
| C. | 將Na2O2投入到FeSO4溶液中,可生成紅褐色沉淀 | |
| D. | 常溫下銅與稀硫酸不反應,加入KNO3晶體后,可生成氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com