
【題目】根據所學知識填空。
(1)根據分子中所含官能團可預測有機化合物的性質.
①下列有機化合物能發生消去反應的是(填字母).
a.CH3COOH b.CH3CH2OH c.CH3CH3
②下列有機化合物能與金屬Na反應的是(填字母)
a.HCOOCH3 b.CH3CHO c. ![]()
③下列有機化合物能與溴水發生加成反應的是(埴字母)
a.CH3CH=CH2b. ![]() c.
c. 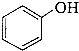
(2)苯乙烯( ![]() )常被用來制作一次性泡沫飯盒的材料聚苯乙烯.
)常被用來制作一次性泡沫飯盒的材料聚苯乙烯.
①苯乙烯是一種單體經過(填反應類型)反應合成聚苯乙烯.
②聚苯乙烯的結構簡式為 .
③苯乙烯與溴的CCl4溶液反應后產物的結構簡式為 .
(3)由苯酚合成 ![]() 的流程如下(部分條件省略)
的流程如下(部分條件省略) 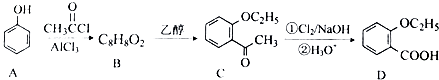
①已知:A→B反應生成B與HCl.寫出有機物B的結構簡式: .
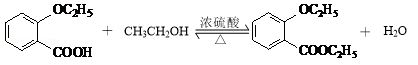
②D與乙醇發生酯化反應的化學方程式為 .
③苯的衍生物X是C的一種同分異構體,能與NaHCO3溶液反應,苯環上含有2個取代基,且分子中只有4種不同化學環境的氫.寫出X的一種結構簡式 .
④檢驗物質D中是否含有A的試劑為 .
【答案】
(1)b;c;a
(2)加聚反應; ;
;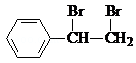
(3)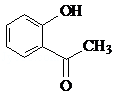 ;
; ;
;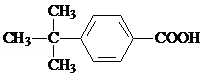 ;FeCl3溶液
;FeCl3溶液
【解析】解:(1)①連接醇羥基或鹵原子的碳原子相鄰碳原子上含有H原子的醇或鹵代烴能發生消去反應,所以只有乙醇符合條件,能發生消去反應,故選b;②羧基和醇羥基能和Na反應生成氫氣,這幾種物質中只有c還有醇羥基,能和鈉反應,故選c;③碳碳不飽和鍵能和溴發生加成反應,只有a中含有碳碳不飽和鍵,能和溴發生加成反應,c能和溴水發生取代反應,故選a;
(2.)①碳碳雙鍵能發生加聚反應生成高分子化合物,苯乙烯中含有碳碳雙鍵,所以能發生加聚反應生成聚苯乙烯,所以答案是:加聚反應;
②聚苯乙烯的結構簡式為  ,所以答案是:
,所以答案是:  ;
;
③苯乙烯和溴能發生加成反應生成 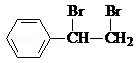 ,
,
所以答案是: 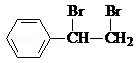 ;
;
(3.)A→B反應生成B與HCl,發生取代反應,B和乙醇發生取代反應生成C,根據C結構知,B結構簡式為 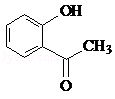 ,C發生取代反應生成D,
,C發生取代反應生成D,
①通過以上分析知,B結構簡式為 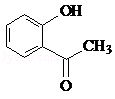 ,所以答案是:
,所以答案是: 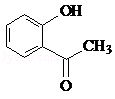 ;
;
②D與乙醇發生酯化反應的化學方程式為  ,
,
所以答案是: 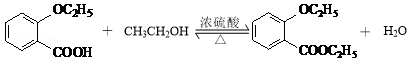 ;
;
③苯的衍生物X是C的一種同分異構體,能與NaHCO3溶液反應,說明含有羧基,苯環上含有2個取代基,且分子中只有4種不同化學環境的氫,則X的一種結構簡式 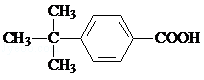 ,所以答案是:
,所以答案是: 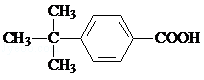 ;
;
④A中含有酚羥基、D中不含酚羥基,可以用氯化鐵溶液檢驗酚羥基,所以檢驗物質D中是否含有A的試劑為
FeCl3溶液,所以答案是:FeCl3溶液.
【考點精析】認真審題,首先需要了解有機物的結構和性質(有機物的性質特點:難溶于水,易溶于汽油、酒精、苯等有機溶劑;多為非電解質,不易導電;多數熔沸點較低;多數易燃燒,易分解).


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】X,Y,Z,W是原子序數依次增大的短周期元素,Y,Z同周期且相鄰,X,W同主族且與Y處于不同周期,Y,Z原子的電子數總和與X,W原子的電子數總和之比為5:4,下列說法正確的是( )
A.原子半徑:r(W)>r(Z)>r(Y)>r(X)
B.Y的簡單氣態氫化物的熱穩定性比Z的強
C.由X,Z組成的化合物與由Z,W組成的化合物只能發生化合反應
D.由X,Y,Z三種元素組成的化合物可以是酸、堿或鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A. ![]() =1×10-13 mol·L-1的溶液中:NH
=1×10-13 mol·L-1的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
B. 使酚酞變紅色的溶液中:Na+、Al3+、SO![]() 、Cl-
、Cl-
C. 與Al反應能放出H2的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 水電離的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是()
A.干冰升華要吸收大量的熱,但不是化學反應中的吸熱反應
B.酒精常被用做酒精燈和內燃機的燃料,說明酒精燃燒是放熱反應
C.人們用氫氧焰焊接或切割金屬,主要是利用了氫氣和氧氣化合時放出的能量
D.常溫下不燃燒,加熱才能燃燒,說明木炭燃燒是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CH3OH(l)的燃燒熱為-726kJ·mol-1,對于反應2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(?)△H=-1452kJ·mol-1中水的狀態判斷正確的是
A.氣態B.液態C.固態D.無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作會促進H2O的電離,且使溶液pH>7的是
A.將純水加熱到90 ℃B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液D.向水中加少量FeCl3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗誤差分析錯誤的是
A. 用濕潤的pH試紙測稀堿液的pH,測定值偏小
B. 用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏小
C. 滴定前滴定管內無氣泡,終點讀數時有氣泡,所測體積偏小
D. 測定中和反應的反應熱時,將堿緩慢倒入酸中,所測溫度值偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗:
【實驗一】配制并標定醋酸溶液的濃度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標準溶液對所稀釋的醋酸溶液的濃度進行標定。請回答下列問題:
(1)配制250 mL 0.2 mol·L-1醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、__________。
(2)為標定某醋酸溶液的準確濃度,用0.200 0 mol·L-1的NaOH溶液對20.00 mL醋酸溶液進行滴定,幾次滴定消耗NaOH溶液的體積如下:
實驗序號 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的體積(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
則①滴定時選用________(A.石蕊 B.酚酞 C.不用指示劑 D.甲基橙)為指示劑(填字母)
②該醋酸溶液的準確濃度為________(保留小數點后四位)。
【實驗二】探究濃度對醋酸電離程度的影響。用pH計測定25 ℃時不同濃度的醋酸溶液的pH,結果如下:
醋酸濃度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根據表中數據,可以得出醋酸是弱電解質的結論,你認為得出此結論的依據是_________________。
(4)從表中的數據,還可以得出另一結論:隨著醋酸濃度的減小,醋酸的電離程度______(填“增大”“減小”或“不變”)。
【實驗三】探究溫度對醋酸電離程度的影響。
(5)要完成該探究,需要用pH計(或pH試紙)測定 ___________________________。
【醋酸電離的應用】
(6)通過實驗測定常溫下醋酸的Ka=1×10-5,則0.1 mol·L-1醋酸鈉溶液的pH=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com