
【題目】氮(N)、磷(P)、砷(As)、銻(Sb)、鉍(Bi)、鏌(Mc)為元素周期表中原子序數依次增大的同族元素。回答下列問題:
(1)砷在周期表中的位置_____,![]() Mc 的中子數為_____。已知存在P(S,紅磷)、P(S,黑磷) 、P(S,白磷),它們互稱為_____。
Mc 的中子數為_____。已知存在P(S,紅磷)、P(S,黑磷) 、P(S,白磷),它們互稱為_____。
(2)熱穩定性:NH3_____PH3(填“>”或“<”),砷的最高價氧化物對應水化物的化學式為_____是一種_____酸(填“強”或“弱”) 。
(3)PH3 和鹵化氫反應與 NH3 相似,產物的結構和性質也相似。寫出 PH3 和 HI 反應的化學方程式_____。
(4)SbCl3 能發生較強烈的水解,生成難溶的 SbOCl,寫出該反應的化學方程式_____,因此,配制 SbCl3溶液時應注意_________。
【答案】第四周期第 VA族 173 同素異形體 > H3AsO4 弱 PH3 + HI = PH4I SbCl3 +H2O![]() SbOCl↓ + 2HCl 用較濃的鹽酸而不是蒸餾水來溶解固體 SbCl3,使用前才稀釋到相應的濃度
SbOCl↓ + 2HCl 用較濃的鹽酸而不是蒸餾水來溶解固體 SbCl3,使用前才稀釋到相應的濃度
【解析】
(1)中子數=質量數-質子數;同種元素組成的不同單質互為同素異形體;
(2)元素的非金屬性越強,氣態氫化物越穩定,最高價含氧酸的酸性越強;
(3)根據NH3 與HCl反應的方程式書寫PH3 和 HI 反應的化學方程式;
(4)SbCl3 能發生較強烈的水解,生成難溶的 SbOCl和鹽酸;
(1)砷在周期表中的位置是第四周期第 VA族,![]() Mc 的中子數為288-115=173; P(S,紅磷)、P(S,黑磷) 、P(S,白磷),都是P元素組成的不同單質,它們互稱為同素異形體;
Mc 的中子數為288-115=173; P(S,紅磷)、P(S,黑磷) 、P(S,白磷),都是P元素組成的不同單質,它們互稱為同素異形體;
(2)同主族元素從上到下非金屬性減弱,非金屬性N>P>As,熱穩定性:NH3>PH3,砷的最高價氧化物對應水化物的化學式為H3AsO4,酸性H3PO4>H3AsO4,所以H3AsO4是弱酸;
(3)根據NH3 與HCl反應的方程式,可知PH3 和 HI 反應的化學方程式是PH3 + HI = PH4I;
(4)SbCl3 能發生較強烈的水解,生成難溶的 SbOCl和鹽酸,反應方程式是SbCl3 +H2O![]() SbOCl↓ + 2HCl;增大鹽酸濃度,水解平衡可逆向移動,抑制SbCl3水解,配制 SbCl3溶液時應注意用較濃的鹽酸而不是蒸餾水來溶解固體 SbCl3,使用前才稀釋到相應的濃度。
SbOCl↓ + 2HCl;增大鹽酸濃度,水解平衡可逆向移動,抑制SbCl3水解,配制 SbCl3溶液時應注意用較濃的鹽酸而不是蒸餾水來溶解固體 SbCl3,使用前才稀釋到相應的濃度。


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素的常見化合價與原子序數的關系圖:

(1)元素A在周期表中的位置__________________________。
(2)用電子式表示D2G的形成過程____________________________,其所含化學鍵類型為___________。
(3)C2-、D+、G2-離子半徑由大到小順序是____________________(用離子符號回答)。
(4)某同學設計實驗證明A、B、F的非金屬性強弱關系。
①溶液a和b分別為______________,________________。
②溶液c中的離子方程式為________________________________________。

(5)將0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①轉移電子的物質的量為_____________________________________。
②用一個離子方程式表示該反應__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.1 mol·L-1NaOH溶液分別滴定20.00mL 0.1 mol·L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法正確的是

A.Ⅰ、Ⅱ分別表示鹽酸和醋酸的滴定曲線
B.pH=7時,滴定鹽酸和醋酸消耗NaOH溶液的體積相等
C.V(NaOH)=10.00mL時,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL時,兩溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、M、Q、R 皆為前 20 號元素,其原子半徑于主要化合價的關系如圖所示。說法錯誤的是

A.Q 位于第三周期 IA 族
B.X、Y、Z 三種元素組成的化合物可能是鹽或堿
C.簡單離子半徑:M -﹥Q+﹥R2+
D.Z 與 M 的最高價氧化物對應水化物均為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組在實驗室用三份不同初始濃度的氨基甲酸銨(NH2COONH4)溶液在不同溫度下進行水解實驗:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,測得c(NH2COO-)與反應時間的關系如圖所示。據圖判斷下列說法正確的是
NH4HCO3+NH3·H2O,測得c(NH2COO-)與反應時間的關系如圖所示。據圖判斷下列說法正確的是
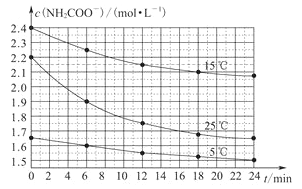
A.0~12min,初始濃度越大的實驗,水解反應速率越大
B.c(NH2COO-)將隨反應時間的不斷延長而不斷減小
C.25℃時,0~6min,v(NH2COO-)為0.05mol·L-1·min-1
D.15℃時,第30min,c(NH2COO-)為2.0mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯酰胺(H2C=CH—CONH2)具有中等毒性,它對人體可造成神經毒性和遺傳毒性。丙烯酰胺主要是由高碳水化合物、低蛋白質的植物性食物在加熱(120℃以上)烹調過程中形成,特別在烘烤、油炸時更易形成。丙烯酰胺可以進一步形成在工業上有用的聚丙烯酰胺類物質。

回答下列問題:
(1)D的結構簡式為___,F的結構簡式為___。
(2)指明下列反應類型:A→B___,C→D___。
(3)丙烯酰胺有多種同分異構體,寫出分子中同時含有醛基和碳碳雙鍵的同分異構體:___。
(4)寫出D→E的化學方程式:__。2分子C在濃硫酸作用下可形成一個六元酯環,該反應的化學方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向![]() 恒容密閉容器中充入
恒容密閉容器中充入![]() 和
和![]() ,發生反應:
,發生反應:![]() 經過一段時間后達到平衡,反應過程中測定的部分數據見下表:
經過一段時間后達到平衡,反應過程中測定的部分數據見下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列說法正確的是![]()
A.反應在前2s的平均速率![]()
B.保持其他條件不變,體積壓縮到![]() ,平衡常數將增大
,平衡常數將增大
C.相同溫度下,起始時向容器中充入![]() ,達到平衡時,
,達到平衡時,![]() 的轉化率等于
的轉化率等于![]()
D.保持溫度不變,向該容器中再充入![]() 、
、![]() ,反應達到新平衡時
,反應達到新平衡時![]() 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述中正確的是( )
A.32 g S8(分子結構:![]() )中的共價鍵數目為NA
)中的共價鍵數目為NA
B.1L、0.1mol/L的Na2CO3溶液中含陰離子總數為0.1NA個
C.標準狀況下,22.4LHF含NA個分子
D.標準狀況下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒數之和為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是第3周期11~17號元素某些性質變化趨勢的柱形圖。下列有關說法中正確的是( )

A.y軸表示的可能是電離能B.y軸表示的可能是電負性
C.y軸表示的可能是原子半徑D.y軸表示的可能是形成基態離子轉移的電子數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com