
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 增大壓強或升高溫度,—定能使化學反應速率加快
B. 己知 Ni(CO)4(g)=Ni(s)+4CO(g) △H=QkJ/mol,則 Ni(s) +4CO(g)=Ni(CO)4(g) △H=-QkJ/mol
C. 500°C、30 MPa下, 0.5 mol N2(g)和1.5mol H2(g)反應生成NH3(g) 放熱QkJ,其熱化學方程式為N2(g)+3 H2(g)![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D. 己知兩個平衡體系:2NiO(s)![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g)![]() 2CO2(g)是平衡常數分別為K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常數分別為K1和K2,可推知平衡NiO(s)+CO(g)![]() Ni(s)+CO2(g)的平衡常數為
Ni(s)+CO2(g)的平衡常數為![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2、CO等大氣污染氣體的測量及處理具有重要意義。
(1)降低汽車尾氣的方法之一是在排氣管上安裝催化轉化器,發生如下反應:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定條件下,將體積比為1:2的NO、CO氣體置于恒容密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是_________(填字母)。
A.體系壓強保持不變 B.混合氣體顏色保持不變
C. N2和CO2的體積比保持不變 D. v正(CO)=2v逆(N2)
②20min時,若改變反應條件,導致N2濃度發生如下圖1所示的變化,則改變的條件可能是_____(填字母)。
A.加入催化劑 B.降低溫度 C.增加CO2量 D.縮小容器體積
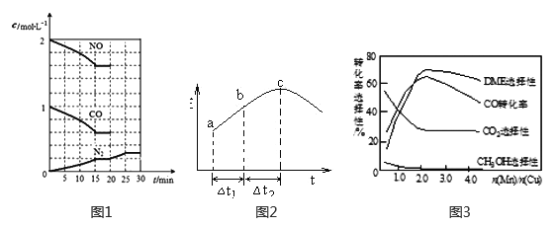
(2)在一定條件下,將SO2和NO2通入絕熱恒容密閉容器中,發生反應:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反應速率隨時間變化如圖2所示。由圖可得出的正確結論是_____________(填字母)。
SO3(g)+NO(g),正反應速率隨時間變化如圖2所示。由圖可得出的正確結論是_____________(填字母)。
A.反應在c點達到平衡狀態
B.反應物濃度:b點小于c點
C.反應物的總能量低于生成物的總能量
D.△t1=△t2 時,SO2的轉化率:a~b段小于b~c段
(3)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2可制備二甲醚(DME)。觀察圖3回答問題。催化劑中n(Mn)/n(Cu)約為__________時最有利于二甲醚的合成。
(4)工業上可以用CO和H2生產燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡的有關數據如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡的有關數據如下:
容器 | 甲 | 乙 | 丙 | |
反應物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 時的 數據 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反應的能量變化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
體系壓強/Pa | p1 | p2 | p3 | |
反應物轉化率 | a1 | a2 | a3 | |
下列說法中正確的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。已知C2H4和C3H6的混合物的質量為14g,有關該混合物的說法錯誤的是( )
A.燃燒時消耗的氧氣為33.6LB.所含碳原子數目為NA
C.所含電子數目為8NAD.所含碳氫鍵數目為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣污染的危害是多方面的,它既危害人體健康,又影響動植物的生長,嚴重時會影響地球的氣候。大氣污染主要是由人為排放的煙塵和有害氣體造成的。
(1)工業接觸法制硫酸的主要反應之一是2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
①一定條件下,將SO2于空氣充分混合并反應。t min后,SO2和SO3物質的量濃度分別為amol/L和bmol/L,則以SO2表示的化學反應速率為________________
②為了提高反應速率,同時提高SO2的轉化率,從而減少SO2的排放,下列條件可改變的是_______
A 增大壓強 b升高溫度 c增大催化劑用量d降低溫度
(2)CO2的過度排放會造成另一種大氣污染——“溫室效應”。CO2是目前大氣中含量最高的一種溫室氣體。因此,控制和治理CO2是解決“溫室效應”的有效途徑
①下列措施中,有利于降低大氣中CO2濃度的有_____________
a.采用節能技術,減少化石燃料的用量
b.鼓勵乘坐公交車出行,倡導低碳生活
c.利用太陽能、風能等新型能源替代化石燃料
②另一種途徑是將CO2轉化成有機物實現碳循環。如:
2CO2(g)+2H2O(l) = C2H4(g)+3O2(g) △H=+1411.0kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(l)+3O2(g) △H=+1366.8 kJ/mol
則由乙烯水化制乙醇的熱化學方程式是:____________________________________________。
③在一定條件下:6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。

根據上表中數據分析:
i.溫度一定時,提高碳氫比[n(H2)/n(CO2)],CO2的轉化率________(填“增大”“減小”或“不變”)
ii.該反應的正反應為_______(填“吸”或“放”)熱反應
iii.為了避免乙醇燃燒釋放CO2,可以設計成乙醇燃料電池,右圖為該電池的結構示意圖(電解質溶液為KOH溶液)。則a處電極上的電極反應式為______________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,相關示意圖錯誤的是
A | B | C | D |
將二氧化硫通入到一定量飽和氯水中 | 將鹽酸滴入到NaHCO3和Na2CO3混合溶液中 | 將銅粉加入到一定量濃硝酸中 | 將鐵粉加入到一定量氯化鐵溶液中 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸亞鉻水合物[Cr(CH3COO)2]2·2H2O是一種氧氣吸收劑,為紅棕色晶體,易被氧化,不溶于水和乙醚(易揮發的有機溶劑),微溶于乙醇,易溶于鹽酸,其制備裝置如下(已知:Cr3+水溶液顏色為綠色,Cr2+水溶液顏色為藍色):

回答下列問題:
(1)裝置甲中連通管a的作用是___________。
(2)向三頸燒瓶中依次加入過量鋅粒、適量CrCl3溶液:關閉K2打開K1,旋開分液漏斗的旋塞并控制好滴速;當觀察到三頸燒瓶中溶液顏色由綠色完全轉變為藍色時,進行的實驗操作為______________,從而將甲中溶液自動轉移至裝置乙中;當觀察到裝置乙中出現________________________時,說明反應基本完成,此時關閉分液漏斗的旋塞。
(3)裝置乙中反應的離子方程式為_____________。
(4)將裝置乙中混合物快速過濾、洗滌和干燥,稱量得到mg[Cr(CH3COO)2]2·2H2O。其中洗滌的目的是去除可溶性雜質和水分,下列洗滌試劑正確的使用順序是_____(填標號。
A.乙醚 B.去氧冷的蒸餾水 C.無水乙醇
(5)若實驗所取用的CrCl3溶液中含溶質ng,則[Cr(CH3COO)2]2·2H2O(相對分子質量為376 )的產率是___________。
(6)該實驗裝置有一個明顯的缺陷是________,解決此缺陷的措施為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com