
已知W、X、Y、Z是短周期元素,aW2+、bX+、cY2-、dZ-具有相同的電子層結構,下列說法正確的是
| A.離子的還原性:Y2-> Z- |
| B.原子半徑:r(W) > r(X) |
| C.質子數:c>a |
| D.W和X兩者最高價氧化物對應的水化物能相互反應 |
A
解析試題分析:依題意推斷,四種離子具有28電子層結構,aW2+、bX+、cY2-、dZ-分別為12Mg2+、11Na+、8O2-、9F-,則W、X、Y、Z分別為Mg、Na、O、F;非金屬性:O<F,則單質的氧化性:O2<F2,由氧化還原反應規律可知,還原性:8O2->9F-,故A正確;原子半徑:Na>Mg,離子半徑:Na+> Mg2+,故B錯誤;c=8,a=12,8<12,則c<a,故C錯誤;氫氧化鎂是中強堿,不是兩性氫氧化物,氫氧化鈉是強堿,二者不能反應,故D錯誤。
考點:考查元素周期表和元素周期律,涉及非金屬性、單質氧化性、簡單陰離子的還原性的比較,原子半徑、質子數、最高價氧化物對應水化物的性質等。


 捷徑訓練檢測卷系列答案
捷徑訓練檢測卷系列答案 小夫子全能檢測系列答案
小夫子全能檢測系列答案科目:高中化學 來源: 題型:單選題
下列說法中,正確的是
| A.酸性:鹽酸>氫硫酸,則得電子能力:Cl>S |
| B.第二周期元素的最高正化合價從左到右依次升高 |
| C.元素原子的最外層電子數越多,其氫化物穩定性越強 |
| D.共價化合物中只存在共價鍵,離子化合物中一定含有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知W.X.Y.Z為短周期元素,W.Z同主族,X.Y.Z同周期,W的氣態氫化物的穩定性大于Z的氣態氫化物的穩定性,X.Y為金屬元素,X的陽離子的氧化性小于Y的陽離子的氧化性。下列說法正確的是( )
| A.W與X形成的化合物中只含離子鍵 |
| B.X、Y、Z、W的原子半徑依次減小 |
| C.W的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點 |
| D.若W與Y的原子序數相差5,則二者形成化合物的化學式一定為Y2W3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知A、B、C、D、E是短周期元素,原子序數依次增大。其中A、E的單質在常溫下呈氣態,B的原子最外層電子數是其電子層數的2倍,C在同周期主族元素中原子半徑最大,D的合金是日常生活中常用的金屬材料。下列說法正確的是
A.B位于元素周期表中第二周期第VIA族
B.工業上常用電解法制備C、D、E的單質
C.C、D的最高價氧化物對應的水化物之間能發生化學反應
D.化合物AE與CE具有相同類型的化學鍵
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
短周期元素X、Y、Z、W的原子序數依次增大,X原子最外層電子數是電子層數的三倍,Y與X可形成Y2X2和Y2X兩種離子化合物,Z原子的核外電子數比Y原子多1,W與X同主族,則
| A.原子半徑:Y< Z < W |
| B.單質的還原性:Y> Z |
| C.氣態氫化物的穩定性:X>W |
| D.Y和Z兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
aXn-和 bYm+為兩種主族元素的離子,它們的核外電子排布相同,下列判斷中正確的是( )
| A.原子序數:X>Y | B.a -n = b+m |
| C.離子半徑:Xn-> Ym+ | D.原子半徑:X>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知某短周期元素原子的第三電子層上排布有5個電子,則該元素在周期表中的位置是( )
| A.第二周期第IVA族 | B.第二周期第VA族 |
| C.第三周期第IVA族 | D.第三周期第VA族 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
X、Y、Z、W均為短周期元素,在周期表中位置如圖,Y原子的最外層電子數是其次外層電子數的3倍。下列說法正確的是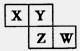
| A.X、Y、Z的原子半徑大小:X>Y>Z |
| B.X、W的氣態氫化物能相互反應,生成共價化合物 |
| C.Z、W的最高價氧化物對應水化物的酸性,前者更強 |
| D.Y的單質與氫氣反應較Z劇烈 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com