
【題目】下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素。試回答下列問題:
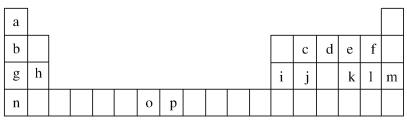
(1)元素p為26號元素,請寫出其基態原子的電子排布式________________。
(2)d與a反應的產物的分子,空間構型為_________________。
(3)h的單質在空氣中燃燒發出耀眼的白光,請用原子結構的知識解釋發光的原因:________________________________________。
(4)o、p兩元素的部分電離能數據列于下表:
元素 | o | p | |
電離能/ (kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比較兩元素的I2、I3可知,氣態o2+再失去一個電子比氣態p2+再失去一個電子難。對此,你的解釋是___________________________________。
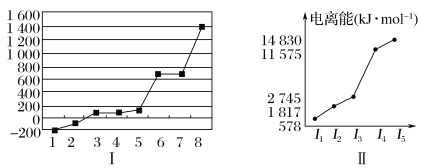
(5)第三周期8種元素按單質熔點高低的順序如圖Ⅰ所示,其中電負性最大的是________(填圖中的序號)。
(6)表中所列的某主族元素的電離能情況如圖Ⅱ所示,則該元素是________(填元素符號)。
【答案】1s22s22p63s23p63d64s2 三角錐形 電子從能量較高的軌道躍遷到能量較低的軌道時,以光(子)的形式釋放能量 Mn2+的3d軌道電子排布為半滿狀態,比較穩定 2 Al
【解析】
根據元素在周期表中的位置知,a到p分別是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
(1)Fe原子核外電子數為26,根據能量最低原理書寫核外電子排布式;
(2)d與a反應的產物為氨氣,中心原子氮原子的價層電子對數判斷氮原子的雜化方式,再確定空間構型;
(3)鎂在空氣中燃燒發出耀眼的白光,在反應過程中電子從能量較高的軌道躍遷到能量較低的軌道時,以光(子)的形式釋放能量,以此答題;
(4)由Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉為不穩定的3d4狀態;而Fe2+到Fe3+時,3d能級由不穩定的3d6到穩定的3d5半充滿狀態;
(5)第三周期8種元素,只有Si單質為原子晶體,熔點最大,分子晶體的熔點低,有磷、硫、氯氣、氬氣幾種物質,但Cl的電負性最大;
(6)根據表中所列的某主族元素的電離能可知,該元素原子最外層電子數為3,據此答題。
根據元素在周期表中的位置知,a到p分別是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
:(1)Fe原子核外電子數為26,根據能量最低原理可知,其核外電子排布式為:1s22s22p63s23p63d64s2;
(2)d與a反應的產物為氨氣,中心原子氮原子形成三個電子對,有一個孤對電子,雜化方式為sp3,分子構型為三角錐形;
(3)鎂在空氣中燃燒發出耀眼的白光,在反應過程中電子從能量較高的軌道躍遷到能量較低的軌道時,以光(子)的形式釋放能量;
(4)由Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉為不穩定的3d4狀態需要的能量較多;而Fe2+到Fe3+時,3d能級由不穩定的3d6到穩定的3d5半充滿狀態,需要的能量相對要少;
(5)第三周期8種元素,只有Si單質為原子晶體,熔點最大,與圖中8對應;分子晶體的熔點低,有磷、硫、氯氣、氬氣幾種物質,但Cl的電負性最大,與圖中2對應;
(6)根據表中所列的某主族元素的電離能可知,該元素原子最外層電子數為3,所以該元素為Al元素。


 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:
【題目】硒(Se)元素是人體必需的微量元素之一。下列說法正確的是
A.硒的攝入量越多對人體健康越好B.SeO32-空間構型為正四面體
C.H2Se的熔沸點比H2S高D.H2SeO4的酸性比H2SO4強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學研究濃度對化學平衡的影響,下列說法正確的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步驟: | 現象: 待試管b中顏色不變后與試管a比較, 溶液顏色變淺。 滴加濃硫酸,試管c溫度略有升高, 溶液顏色與試管a相比,變深。 |
A. 該反應是一個氧化還原反應
B. 待試管b中溶液顏色不變的目的是使Cr2O72-完全反應
C. 該實驗不能證明減小生成物濃度,平衡正向移動
D. 試管c中的現象說明影響平衡的主要因素是溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列幾種有機物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2=CH—CH=CH2 E.環戊烷
(1)上述有機物中互為同系物的是_____________,互為同分異構體的是____________。
(2)1molE完全燃燒消耗氧氣的物質的量____________________。
(3)C與Cl2反應的類型為_____________;D使溴水褪色的反應類型為___________。
(4)B在催化劑條件下發生加聚反應的化學方程式為_________________________。
(5)C的同分異構體中含有三個支鏈的結構簡式______________,其系統命名為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯酚是一種重要的化工原料。以苯酚為主要起始原料,經下列反應可制得香料M和高分子化合物N.(部分產物及反應條件已略去)

(1)B的官能團的名稱是_______________。
(2)已知C的分子式為C5H12O,C能與金屬Na反應,C的核磁共振氫譜有3組峰,則C的結構簡式 ______________________。
(3)由D生成N的反應類型是_________,B與C反應生成M的反應類型是_________。
(4)寫出M與NaOH溶液反應的化學方程式是__________________________________。
(5)物質F的結構是: ,則符合下列條件的F的同分異構體有 ______種。
,則符合下列條件的F的同分異構體有 ______種。
①能發生銀鏡反應 ②能與NaHCO3溶液反應 ③分子中有苯環,無 結構。其中苯環上只有兩個取代基,且核磁共振氫譜有4組峰,峰面積之比為1:2:2:1的為___________(寫結構簡式)。
結構。其中苯環上只有兩個取代基,且核磁共振氫譜有4組峰,峰面積之比為1:2:2:1的為___________(寫結構簡式)。
(6)已知: ,寫出以苯酚、乙醇和ClCH2COOH為原料制備
,寫出以苯酚、乙醇和ClCH2COOH為原料制備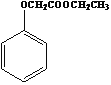 的合成路線流程圖(無機試劑任用)。___________
的合成路線流程圖(無機試劑任用)。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有a、b、c、d四個金屬電極,有關的反應裝置及部分反應現象如下:
實驗裝置 |
|
|
|
|
部分實驗現象 | a極質量減小 b極質量增加 | 溶液中的H+向c極移動 | d極溶解 c極有氣體產生 | 電流從a極流出 |
由此可判斷這四種金屬的活動性順序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列有關敘述正確的是
A.標準狀況下,22.4L已烷含有的共價鍵總數為19NA
B.16 g O2和14C2H4的混合物中所含中子數為8NA
C.1 L 0.1 mol·L-1 Na2CO3溶液中陰陽離子數之和為0.3NA
D.密閉容器中1.5 mol H2與0.5 mol N2充分反應,得到NH4的分子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量純凈的氨基甲酸銨(NH2COONH4)置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判斷該分解反應已經達到化學平衡狀態的是( )
2NH3(g)+CO2(g),下列可以判斷該分解反應已經達到化學平衡狀態的是( )
A. 2v(NH3)=v(CO2) B. 密閉容器中總壓強不變
C. 密閉容器中混合氣體的平均摩爾質量不變 D. 密閉容器中氨氣的體積分數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列幾組物質,請將序號填入下列空格內:
A.CH2=CHCOOH和CH2=CH(CH2 )4 COOH B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互為同位素的是________;
(2)互為同系物的是________;
(3)互為同素異形體的是________;
(4)互為同分異構體的是________;
(5)既不是同系物,又不是同分異體,也不是同素異形體,但可看成是同一類物質的是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com