
| 氣體 | 氮氣 | 氫氣 | 氨 |
| 熔點(℃) | -210.01 | -252.77 | -77.74 |
| 沸點(℃) | -195.79 | -259.23 | -33.42 |
 2NH3(g)反應中,隨著反應的進行,反應物的物質的量逐漸減少,生成物的物質的量逐漸增多,當達到平衡狀態時,正逆反應速率相等,反應物的生成物的物質的量不再改變,曲線為水平直線,以此判斷.
2NH3(g)反應中,隨著反應的進行,反應物的物質的量逐漸減少,生成物的物質的量逐漸增多,當達到平衡狀態時,正逆反應速率相等,反應物的生成物的物質的量不再改變,曲線為水平直線,以此判斷.

科目:高中化學 來源: 題型:閱讀理解

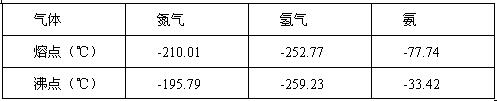
反應體系中各組分的部分性質見下表:
氣體 | 氮氣 | 氫氣 | 氨 |
熔點/℃ | -210.01 | -252.77 | -77.74 |
沸點/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反應的平衡常數很小,所以在工業上采取氣體循環的流程,即反應后通過把混合氣體的溫度降低到____________,使混合氣體分離出產品,N2、H2繼續循環。寫出該反應的化學平衡常數表達式:K=____________。
(2)運用化學反應速率和化學平衡的觀點說明工業上采用“使混合氣體分離出產品,N2、H2繼續循環”的生產措施的理由:___________________________________________________。
(3)已知拆開1 mol H—H鍵、1 mol N—H鍵、1 mol N≡N鍵分別需要的能量是436 kJ、391 kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為_____________________________。
(4)合成氨工業對國民經濟和社會發展具有重要的意義。對于密閉容器中的反應:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)隨時間變化的關系如下圖甲所示。下列敘述正確的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)隨時間變化的關系如下圖甲所示。下列敘述正確的是____________。
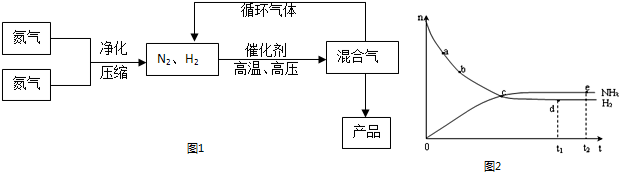
A.點a的正反應速率比點b的大
B.點c處反應達到平衡
C.點d(t1時刻)和點e(t2時刻)處n(N2)不一樣
D.其他條件不變,773 K下反應至t1時刻,n(H2)比圖中d點的值大
(5)1998年希臘亞里斯多德大學的Marncellos和Stoukides采用高質子導電性的SCY陶瓷(能傳遞H+),實現了高溫常壓下高轉化率的電化學合成氨,其實驗裝置如下圖乙。陰極的電極反應式為__________________________________________________________________。


甲 乙
查看答案和解析>>
科目:高中化學 來源:2013屆安徽省高二第二次月考理科綜合試題(化學部分) 題型:填空題
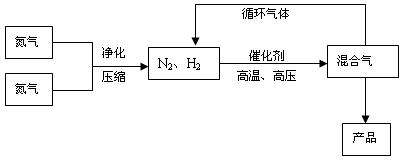
(15分)氨是最重要的氮肥,是產量最大的化工產品之一。課本里介紹的合成氨技術叫哈伯法,是德國人哈伯在1905年發明的,其合成原理為:N2(g)+3H2(g)  2NH3(g);△H<0他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下:
2NH3(g);△H<0他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下:

|
氣體 |
氮氣 |
氫氣 |
氨 |
|
熔點(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸點(℃) |
-195.79 |
-259.23 |
-33.42 |
反應體系中各組分的部分性質見上表:
(1)合成氨反應的平衡常數很小,所以在工業上采取氣體循環的流程。即反應后通過把混合氣體的溫度降低到 ℃使混合氣體分離出來產品;繼續循環的氣體是 。
(2)工業上采取用上述(1)操作的目的:
。
(3)已知拆開1molH-H鍵,1molN-H鍵,1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為________________________ 。
(4)合成氨工業對國民經濟和社會發展具有重要的意義。對于密閉容器中的反應: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如下圖所示。下列敘述正確的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如下圖所示。下列敘述正確的是

A.點a的正反應速率比點b的大
B.點 c處反應達到平衡
C.點d (t1時刻) 和點 e (t2時刻) 處n(N2)不一樣
D.其他條件不變,773K下反應至t1時刻, n(H2)比上圖中d點的值大
查看答案和解析>>
科目:高中化學 來源: 題型:
氨是最重要的氮肥,是產量最大的化工產品之一,其合成原理為
N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ/moL。試回答下列問題:
2NH3(g) △H=-92.4KJ/moL。試回答下列問題:
氨的合成是一個可逆反應,為了探索合成氨的最佳條件,人們進行了大量的研究。
(1) 下列有關做法不適宜的是( )
A、常采用循環法,使未轉化的氮氣和氫氣得到充分的利用。
B 、綜合考慮各方面的因素,壓強控制在20―50MPa之間為宜
C、利用電解水制氫氣,作為合成氨的原料,
D、使用鐵觸媒為催化劑,在5000C時獲得最大催化效益。
(2)合成氨工業中采取的下列措施可用勒夏特列原理解釋的是 (填序號)
A 、采用較高壓強(20―50MPa)
B、采用5000C的高溫
C、用鐵觸媒為催化劑
D、將生產的氨液化并及時從體系中分離出來,N2和H2循環到合成塔中并補充N2和H2
(3)在298K時,將10moL N2和30moL H2放入合成塔中,為何放出的熱量小于924KJ?
(4)怎樣知道在合成氨工業有氨氣生成?
如果提高單位時間內氨氣的產量,對溫度而言,在 (填高溫或低溫)下有利.
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
氨是最重要的氮肥,是產量最大的化工產品之一。課本里介紹的合成氨技術
叫哈伯法,是德國人哈伯1905年發明的,其合成原理為:N2(g) + 3H2(g) ![]() 2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下:
2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下:
反應體系中各組分的部分性質見下表:
(1)下列說法正確的是
A. 因為△H= -92.4 kJ/mol,所以該反應一定能自發進行
B. 因為△S = -198.3J·mol-1·K-1所以該反應一定不能自發進行
C. 該反應在一定條件下可能自發進行。
(2)合成氨反應的平衡常數很小,所以在工業上采取氣體循環的流程。即反應后通過把混合氣體的溫度降低到 使混合氣體分離出來產品;繼續循環的氣體是 。
(3)一定溫度下,在密閉容器中充入1 mol N2和3 mol H2并發生反應。
①若容器容積恒定,達到平衡時,氣體的壓強為原來的7/8,則N2的轉化率а1= ,此時反應放熱 kJ;
②若容器壓強恒定,則達到平衡時,容器中N2的轉化率а2 а1(填“>、<或=”)。
(4)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對N2(g)+3H2(g)![]() 2NH3(g) 反應的影響。
2NH3(g) 反應的影響。
實驗結果如圖所示:(圖中T表示溫度,n表示物質的量)
① 圖像中T2和T1的關系是:T2 T1,(填“高于”“低于”“等于”“無法確定”)
② 比較在a、b、c三點所處的平衡狀態中,反應物N2 的轉化率最高的是 (填字母)。
③ 在起始體系中加入N2的物質的量為n/3mol時,反應后氨的百分含量最大;若容器容積為1L,n=3mol反應達到平衡時H2的轉化率為60%,則此條件下(T2),反應的平衡常數K= 。(不用寫單位)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com